Er fluor en meget stærkere oxidation end ilt?
* Elektronegativitet: Fluor er det mest elektronegative element på den periodiske tabel. Dette betyder, at det har en meget stærkere attraktion for elektroner end ilt.
* Elektronaffinitet: Fluor har en højere elektronaffinitet end ilt, hvilket betyder, at den frigiver mere energi, når den får en elektron.
* obligationsstyrke: F-F-bindingen i fluordas er svagere end O-O-bindingen i iltgas. Dette gør fluor mere tilbøjelig til at bryde sin binding og reagere med andre stoffer for at få et elektron.
på enkle termer: Fluor er så ivrig efter at få et elektron til at afslutte sin ydre skal, at det let vil trække elektroner væk fra andre elementer og oxidere dem i processen.
Eksempler:
* Fluor kan oxidere vand og producere ilt og hydrofluorinsyre.
* Fluor kan reagere med ædelgasser som Xenon for at danne forbindelser som XEF2 og XEF4. Disse reaktioner er ekstremt vanskelige at opnå med ilt.
Bemærk: Mens fluor er en meget stærk oxidation, er det vigtigt at huske, at både ilt og fluor kan fungere som oxidationsmidler afhængigt af den specifikke kemiske reaktion.
Sidste artikelGiv navnet på forbindelse, hvor klor danner brintbinding?
Næste artikelHvordan dannes vismuth?
 Varme artikler
Varme artikler
-
 Forskere udvikler molekyle til lagring af solenergiBo Durbeej og hans gruppe bruger avancerede computersimuleringer af kemiske reaktioner, som udføres på National Supercomputer Center, NSC, i Linköping. Forskere ved Linköpings universitet, Sverige
Forskere udvikler molekyle til lagring af solenergiBo Durbeej og hans gruppe bruger avancerede computersimuleringer af kemiske reaktioner, som udføres på National Supercomputer Center, NSC, i Linköping. Forskere ved Linköpings universitet, Sverige -
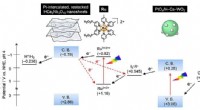 Ny fotokatalysator øger vandspaltningseffektiviteten til ren brintproduktionOxygenudviklingskatalysatoren reducerer effektivt koncentrationen af I3 - ioner og ændringer i hydrogenudviklingskatalysatoren forhindrer elektrontilbageførsel (stiplede røde linjer) og prioriterer
Ny fotokatalysator øger vandspaltningseffektiviteten til ren brintproduktionOxygenudviklingskatalysatoren reducerer effektivt koncentrationen af I3 - ioner og ændringer i hydrogenudviklingskatalysatoren forhindrer elektrontilbageførsel (stiplede røde linjer) og prioriterer -
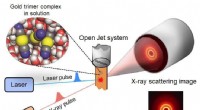 Hvert øjeblik med ultrahurtig kemisk binding fanget på filmBindingsdannelsesreaktionen i et guldtrimerkompleks initieres af en laserpuls, og en tredimensionel struktur efter en bestemt tidsforsinkelse detekteres af et røntgenstrålingsbillede. Kredit:IBS M
Hvert øjeblik med ultrahurtig kemisk binding fanget på filmBindingsdannelsesreaktionen i et guldtrimerkompleks initieres af en laserpuls, og en tredimensionel struktur efter en bestemt tidsforsinkelse detekteres af et røntgenstrålingsbillede. Kredit:IBS M -
 Hackmanite ændrer også farve ved udsættelse for nuklear stråling:Hukommelsessporing muliggør ny…Hackmanitplader, der har skiftet farve ved stråling i laboratoriet hos den finske strålings- og nuklearsikkerhedsmyndighed. Pladerne viser den uddybende farve, efterhånden som stråledosis øges:Jo kort
Hackmanite ændrer også farve ved udsættelse for nuklear stråling:Hukommelsessporing muliggør ny…Hackmanitplader, der har skiftet farve ved stråling i laboratoriet hos den finske strålings- og nuklearsikkerhedsmyndighed. Pladerne viser den uddybende farve, efterhånden som stråledosis øges:Jo kort
- Probiotika hjælper poppeltræer med at rense toksiner på Superfund-websteder
- Hvad er accelerationen af en 8 kg baby trukket opad med kraft 150 Newtons?
- Er bevægelsen af energi fra et varmere objekt til køler kaldes varmeoverførsel sand eller falsk…
- Månelanderen Odysseus har et nyt hjem og tager et kunstnerisk projekt med på turen
- Hvad er energitransformationen, når man spiser mad?
- Dine oplysninger er blevet hacket. Hvad gør du nu?


