Hvad er reaktionen af fluor og kaliumiodid?
Her er den afbalancerede kemiske ligning:
f₂ (g) + 2ki (s) → 2kf (s) + i₂ (s)
Forklaring:
* fluor (F₂) er en meget reaktiv halogen , hvilket betyder, at det let accepterer elektroner.
* kaliumiodid (KI) er en ionisk forbindelse med kalium (K⁺) og iodid (I⁻) -ioner.
* Fluor er mere elektronegativ end jod, så det vil fortrænge iodid fra forbindelsen.
* Reaktionen resulterer i dannelsen af kaliumfluorid (KF), en anden ionisk forbindelse og elementær jod (I₂).
Nøglepunkter:
* Reaktionen er meget eksoterm , hvilket betyder, at det frigiver en betydelig mængde varme.
* Reaktionen er kraftig , hvilket betyder, at det fortsætter hurtigt.
* Denne reaktion er et klassisk eksempel på en halogenfortrængningsreaktion .
* På grund af den ekstreme reaktivitet af fluor er det vigtigt at håndtere denne reaktion med ekstrem forsigtighed og kun i en godt ventileret laboratorieindstilling med passende sikkerhedsudstyr.
Bemærk: Denne reaktion bruges typisk ikke i hverdagens applikationer. Det bruges primært til at demonstrere reaktiviteten af fluor og begrebet halogenfortrængning.
Sidste artikelEr opvarmning af natriumchlorid en kemisk ændring?
Næste artikelEr natriumaluminiumphosphat en ionisk forbindelse?
 Varme artikler
Varme artikler
-
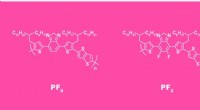 Forskere opgraderer organiske solceller til brug i tagsten, der producerer strømStrukturen af en gentagende enhed i polymerkæden uden fluor (venstre) og efter fluorering (højre). Kredit:Elena Khavina/MIPT Et internationalt team af materialeforskere fra Frankrig, Rusland og
Forskere opgraderer organiske solceller til brug i tagsten, der producerer strømStrukturen af en gentagende enhed i polymerkæden uden fluor (venstre) og efter fluorering (højre). Kredit:Elena Khavina/MIPT Et internationalt team af materialeforskere fra Frankrig, Rusland og -
 En miljøvenlig, lavprisløsning til spildevandsrensningKredit:somsak nitimongkolchai, Shutterstock Forskere udviklede et bæredygtigt spildevandsbehandlingssystem lavet af landbrugs- og industriaffald. Ifølge FNs skøn, to tredjedele af verdens befolkn
En miljøvenlig, lavprisløsning til spildevandsrensningKredit:somsak nitimongkolchai, Shutterstock Forskere udviklede et bæredygtigt spildevandsbehandlingssystem lavet af landbrugs- og industriaffald. Ifølge FNs skøn, to tredjedele af verdens befolkn -
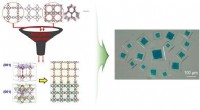 Algoritme identificerer optimale par til at sammensætte metal-organiske rammerFigur:Et eksempel på en rationelt syntetiseret MOF@MOFs (kubisk HKUST-1@MOF-5 ). Kredit:Korea Advanced Institute of Science and Technology (KAIST) Integrationen af metal-organiske rammer (MOFer
Algoritme identificerer optimale par til at sammensætte metal-organiske rammerFigur:Et eksempel på en rationelt syntetiseret MOF@MOFs (kubisk HKUST-1@MOF-5 ). Kredit:Korea Advanced Institute of Science and Technology (KAIST) Integrationen af metal-organiske rammer (MOFer -
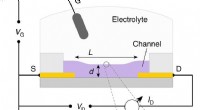 Ny metode benchmarks organiske blandede ledereOECT beskrivelse og betjening. et OECT -tværsnit, ledninger, og dimensioner:kanallængde (L), og tykkelse (d). Kilden, dræne, og port (S, D, G, henholdsvis), og relevante spændinger (gate, afløbsspændi
Ny metode benchmarks organiske blandede ledereOECT beskrivelse og betjening. et OECT -tværsnit, ledninger, og dimensioner:kanallængde (L), og tykkelse (d). Kilden, dræne, og port (S, D, G, henholdsvis), og relevante spændinger (gate, afløbsspændi
- Hvilket molekyle indeholder carbonoxygen og nitrogen?
- Huawei åbner sikkerhedslaboratorium i Bruxelles for at berolige EU
- En mere sikker måde for politiet at teste narkotikabeviser på
- Kan aromaterapi producere skadelige indendørs luftforurenende stoffer?
- Flytter ladede partikler inde i Jorden, når de drejer på sin akse?
- Plastsolceller kombinerer højhastigheds optisk kommunikation med indendørs energihøst


