Hvorfor ønsker natrium at binde sig sammen med klor?
* natrium (NA): Har en elektron i sin yderste skal. Det er relativt let for natrium at miste dette elektron og blive en positivt ladet ion (Na+). Dette gør det mere stabilt.
* klor (Cl): Har syv elektroner i sin yderste skal. Det har brug for endnu en elektron for at opnå en stabil, fuld ydre skal. Dette gør det meget elektronegativt - det ønsker virkelig at få en elektron.
Bindingsprocessen:
1. attraktion: Den positivt ladede natriumion (Na+) tiltrækkes stærkt af den negativt ladede chloridion (Cl-).
2. ionisk binding: Denne attraktion fører til dannelse af en ionisk binding. Natriumatomet giver sit ydre elektron til chloratomet, hvilket resulterer i dannelse af natriumchlorid (NaCl), også kendt som tabel salt.
I det væsentlige: Natrium ønsker at miste et elektron for at blive stabilt, mens klor ønsker at få et elektron for at blive stabilt. De opnår denne stabilitet ved at danne en ionisk binding, hvor natrium mister sin elektron, og klor får den. Dette skaber en stærk elektrostatisk tiltrækning mellem de to ioner.
Sidste artikelHvilke mineraler fremstiller svovl?
Næste artikelHvordan kan brint opnås?
 Varme artikler
Varme artikler
-
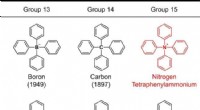 Syntese af tetraphenylammonium:Bekræftelse af eksistensen af fantomionenFigur 1. Strukturer af tetraphenyl-substituerede grundstoffer, der tilhører grupperne 13-15. Tallet i parentes angiver synteseåret. Kredit:Kanazawa University Tetraphenylammonium, med alle fire hyd
Syntese af tetraphenylammonium:Bekræftelse af eksistensen af fantomionenFigur 1. Strukturer af tetraphenyl-substituerede grundstoffer, der tilhører grupperne 13-15. Tallet i parentes angiver synteseåret. Kredit:Kanazawa University Tetraphenylammonium, med alle fire hyd -
 At finde giftige kræftfremkaldende metaller hurtigere i fødevarer og vandKredit:CC0 Public Domain Forskere ved University Johannesburg har udviklet en effektiv og mere følsom metode til at teste for farlige niveauer af tungmetaller som arsen, cadmium og chrom i grøntsa
At finde giftige kræftfremkaldende metaller hurtigere i fødevarer og vandKredit:CC0 Public Domain Forskere ved University Johannesburg har udviklet en effektiv og mere følsom metode til at teste for farlige niveauer af tungmetaller som arsen, cadmium og chrom i grøntsa -
 Enheden forfiner analysen af materialer til brændselsceller og batterierSkematisk af ny celle:(1) gevindlæbe; (2) blænde til gennemstrømning af stråling; (3) vindue; (4, 5, 17) O-ring; (6, 16) modelektrode; (7) cellelegemedel 1; (8) kammer til elektrolyt, modelektrode og
Enheden forfiner analysen af materialer til brændselsceller og batterierSkematisk af ny celle:(1) gevindlæbe; (2) blænde til gennemstrømning af stråling; (3) vindue; (4, 5, 17) O-ring; (6, 16) modelektrode; (7) cellelegemedel 1; (8) kammer til elektrolyt, modelektrode og -
 Samarbejdet forskning kan føre til forbedringer i produktionen af kulfiberKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Infrarød (IR) billedteknologi ved den australske Synchrotron, udviklet specielt til kulfiberanalyse, har bidraget til en bedre
Samarbejdet forskning kan føre til forbedringer i produktionen af kulfiberKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Infrarød (IR) billedteknologi ved den australske Synchrotron, udviklet specielt til kulfiberanalyse, har bidraget til en bedre
- Hvad er stedet var to luftmasser af forskellige temperaturer eller fugtindhold mødes?
- Hvorfor kan klimaer undertiden variere meget inden for en kort afstand?
- Hvad bruger du guldchlorid til?
- Hvad var sprogstilen for snehvide og syv dværge?
- Andemad er en utrolig, strålingsbekæmpende astronautfødevare - og ved at ændre, hvordan den voks…
- Undersøgelse af vandstrøm for mere effektive akvaponiske systemer


