Hvorfor er smeltepunktet for NaCl meget højere end CH4?
* NaCl (natriumchlorid) :NaCl er en ionisk forbindelse, hvilket betyder, at den holdes sammen af stærke elektrostatiske attraktioner mellem positivt ladede natriumioner (Na+) og negativt ladede chloridioner (CL-). Disse ioniske bindinger er meget stærke og kræver en betydelig mængde energi for at bryde, hvilket resulterer i et højt smeltepunkt (801 ° C).
* CH4 (metan) :Metan er en kovalent forbindelse, hvilket betyder, at den holdes sammen ved deling af elektroner mellem kulstof- og brintatomer. Disse kovalente bindinger, selvom de er stærke inden for molekylet, er svagere end de ioniske bindinger i NaCl. Endvidere holdes metanmolekyler sammen af svage London -spredningskræfter, som er midlertidige attraktioner mellem molekyler. Disse svage kræfter overvindes let, hvilket resulterer i et meget lavt smeltepunkt (-182,5 ° C).
Kortfattet:
* stærkere binding: Ioniske bindinger i NaCI er meget stærkere end de kovalente bindinger i CH4.
* svage intermolekylære kræfter: CH4 har meget svage intermolekylære kræfter, hvilket gør det nemt at smelte.
Den betydelige forskel i bindingsstyrke oversættes direkte til en enorm forskel i deres smeltepunkter.
 Varme artikler
Varme artikler
-
 Forskere udvikler fotostimuleret gennemsigtig glaskeramikKredit:CC0 Public Domain Magnetisk datalagring er gradvist blevet erstattet af optisk datalagring (ODS) med højere effektivitet, lavere energiforbrug, større kapacitet, og længere levetid. Som en
Forskere udvikler fotostimuleret gennemsigtig glaskeramikKredit:CC0 Public Domain Magnetisk datalagring er gradvist blevet erstattet af optisk datalagring (ODS) med højere effektivitet, lavere energiforbrug, større kapacitet, og længere levetid. Som en -
 En bedre HIV-testCheng-ting Jason Tsai, en kandidatstuderende i laboratoriet hos Carolyn Bertozzi, og Peter Robinson, en tidligere kandidatstuderende hos Bertozzi, i 2016, arbejde på en tidligere version af deres test
En bedre HIV-testCheng-ting Jason Tsai, en kandidatstuderende i laboratoriet hos Carolyn Bertozzi, og Peter Robinson, en tidligere kandidatstuderende hos Bertozzi, i 2016, arbejde på en tidligere version af deres test -
 U i Minnesota får tilskud til at udvikle bedre majsbaseret plastKredit:CC0 Public Domain Kornbønder i Minnesota investerer i forskning ved University of Minnesota med det formål at udvikle en mere nyttig majsbaseret plast. Minnesota Corn Growers Association a
U i Minnesota får tilskud til at udvikle bedre majsbaseret plastKredit:CC0 Public Domain Kornbønder i Minnesota investerer i forskning ved University of Minnesota med det formål at udvikle en mere nyttig majsbaseret plast. Minnesota Corn Growers Association a -
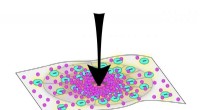 Under pres:Nyt bioinspireret materiale kan formskifte til eksterne kræfterTil JHU-teamets eksperiment, øget kraft (pilen peger nedad) påført materialet førte til flere elektriske ladninger, og dermed, mere mineralisering. Kredit:Pam Li/Johns Hopkins University Inspirere
Under pres:Nyt bioinspireret materiale kan formskifte til eksterne kræfterTil JHU-teamets eksperiment, øget kraft (pilen peger nedad) påført materialet førte til flere elektriske ladninger, og dermed, mere mineralisering. Kredit:Pam Li/Johns Hopkins University Inspirere
- Forskere vurderer, hvor store dinosaurer virkelig kan blive
- Liste over insekter med ufuldstændig metamorfose
- Ny undersøgelse afslører, hvordan parasitter former komplekse fødevæv
- Hvordan brugte Wright Brothers Scienific Method?
- Fosforunderskud kan forstyrre regionale fødevareforsyningskæder
- Hvordan hjælper folk økosystemet?


