Hvad hedder hybrid orbitaler brugt af svovl i SCL2?
Her er hvorfor:
* Svovls elektronkonfiguration: Svovl har 6 valenselektroner (3S² 3P⁴).
* limning i Scl₂: Svovl danner to enkeltbindinger med to kloratomer.
* Hybridisering: For at imødekomme de to bindingspar og to ensomme par elektroner omkring svovl gennemgår det SP³ hybridisering. Dette skaber fire ækvivalente sp³-hybrid-orbitaler, hvor to holder de ensomme par og de to andre overlappende med klororbitaler for at danne S-CL-bindingerne.
Sidste artikelHvad er fordele og ulemper ved smeltende kobber?
Næste artikelHvad er egenskaberne ved kobbermalm?
 Varme artikler
Varme artikler
-
 Forskere identificerer enzym, der er ansvarligt for at hjælpe kræfttumorer med at sprede sigSteven Van Doren afslørede, hvordan et kræftkritisk enzym er placeret på celleoverflader. Kredit:University of Missouri-Columbia Forskere ved University of Missouri har opdaget, hvordan et kræftkr
Forskere identificerer enzym, der er ansvarligt for at hjælpe kræfttumorer med at sprede sigSteven Van Doren afslørede, hvordan et kræftkritisk enzym er placeret på celleoverflader. Kredit:University of Missouri-Columbia Forskere ved University of Missouri har opdaget, hvordan et kræftkr -
 Forskere skaber kunstig perlemor ved hjælp af bakterierDenne abalone skal er en naturlig form for nacre-også kendt som perlemor-et usædvanligt hårdt materiale, der findes i skaller og perler. Rochester biologer har udviklet en innovativ metode til at skab
Forskere skaber kunstig perlemor ved hjælp af bakterierDenne abalone skal er en naturlig form for nacre-også kendt som perlemor-et usædvanligt hårdt materiale, der findes i skaller og perler. Rochester biologer har udviklet en innovativ metode til at skab -
 Enheden binder metal og plastik på få sekunderSammenføjningspistolen binder metal og plastik på få sekunder og kan monteres på en robotarm i stedet for en punktsvejsepistol, for eksempel. Kredit:Fraunhofer IWS Forskere ved Fraunhofer Institut
Enheden binder metal og plastik på få sekunderSammenføjningspistolen binder metal og plastik på få sekunder og kan monteres på en robotarm i stedet for en punktsvejsepistol, for eksempel. Kredit:Fraunhofer IWS Forskere ved Fraunhofer Institut -
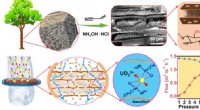 Teamet finder ud af, at biologiske nanofibriller effektivt kan udvinde værdifulde metalelementer fr…Indkapsling af amidoximerede nanofibrøse aerogeler i træcelletraceider for effektiv adsorption af uraniumioner gennem kaskadefiltrering. Kredit:Weihua Zhang Mange værdifulde metaller som guld, sølv
Teamet finder ud af, at biologiske nanofibriller effektivt kan udvinde værdifulde metalelementer fr…Indkapsling af amidoximerede nanofibrøse aerogeler i træcelletraceider for effektiv adsorption af uraniumioner gennem kaskadefiltrering. Kredit:Weihua Zhang Mange værdifulde metaller som guld, sølv
- En elektron har en større masse end proton?
- Sådan fungerer røghoppere
- Ny teknik til oprettelse af sammenfiltrede fotonstater
- Sådan beregnes Overturning Moment
- Hvilken videnskabelig metode følger eksperimentet?
- Hvordan kan du afgøre, om en kemisk reaktion repræsenterer enkeltforskydningsreaktion eller dobbel…


