Hvordan kan du afgøre, om en kemisk reaktion repræsenterer enkeltforskydningsreaktion eller dobbeltforskydningsreaktion?
I en enkeltforskydningsreaktion fortrænger et grundstof et andet grundstof i en forbindelse. Den generelle form for en enkeltforskydningsreaktion er:
```
A + BC → AC + B
```
hvor A er det fortrængende grundstof, B er det grundstof der fortrænges, og C er anionen (negativ ion) af forbindelsen.
For eksempel, når jern (Fe) tilsættes til kobbersulfat (CuSO4), fortrænger jernet kobberet fra forbindelsen og danner jernsulfat (FeSO4) og kobbermetal (Cu).
```
Fe + CuSO4 → FeSO4 + Cu
```
Dobbeltforskydningsreaktion:
I en dobbeltforskydningsreaktion bytter to grundstoffer i to forskellige forbindelser plads. Den generelle form for en dobbeltforskydningsreaktion er:
```
AB + CD → AD + CB
```
hvor A og C er kationerne (positive ioner) af forbindelserne, og B og D er anionerne.
For eksempel, når natriumchlorid (NaCl) tilsættes til sølvnitrat (AgNO3), bytter natrium- og sølvionerne plads og danner natriumnitrat (NaNO3) og sølvchlorid (AgCl).
```
NaCl + AgNO3 → NaNO3 + AgCl
```
Sådan bestemmer du, om en reaktion er en enkelt- eller dobbeltforskydningsreaktion:
For at afgøre, om en kemisk reaktion repræsenterer en enkelt- eller dobbeltforskydningsreaktion, skal du se på antallet af reaktanter og produkter. I en enkeltfortrængningsreaktion er der to reaktanter og to produkter. I en dobbeltforskydningsreaktion er der fire reaktanter og fire produkter.
I en enkeltforskydningsreaktion fortrænges et grundstof desuden af et andet grundstof. I en dobbeltforskydningsreaktion bytter to grundstoffer i to forskellige forbindelser plads.
 Varme artikler
Varme artikler
-
 Sjældne jordarters elementer i mineindustriens affaldsbunkerWenzhong Zhang er miljøforkæmper fra Helsinki Universitet, der i sin doktorafhandling inden for kemien beskriver en metode til at opfange små mængder sjældne jordarters grundstoffer fra aluminiumsindu
Sjældne jordarters elementer i mineindustriens affaldsbunkerWenzhong Zhang er miljøforkæmper fra Helsinki Universitet, der i sin doktorafhandling inden for kemien beskriver en metode til at opfange små mængder sjældne jordarters grundstoffer fra aluminiumsindu -
 Nye modeller til at udforske mikrostrukturen af polymerblandingerKredit:Shutterstock En velkendt metode til fremstilling af polymermaterialer er at blande eller blande flere polymerer. For disperse blandinger, to flydende polymerer blandes ikke godt med hinande
Nye modeller til at udforske mikrostrukturen af polymerblandingerKredit:Shutterstock En velkendt metode til fremstilling af polymermaterialer er at blande eller blande flere polymerer. For disperse blandinger, to flydende polymerer blandes ikke godt med hinande -
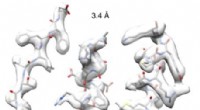 Kryo-EM-billeder i høj opløsning fra Afrika baner vejen for skræddersyede nitrilaser til industri…Ved at maskere en enkelt spiralformet drejning og behandle dette som en enkelt partikel, forskerne var i stand til at forbedre opløsningen væsentligt. Kredit:Diamond lyskilde Et team fra Cape Town
Kryo-EM-billeder i høj opløsning fra Afrika baner vejen for skræddersyede nitrilaser til industri…Ved at maskere en enkelt spiralformet drejning og behandle dette som en enkelt partikel, forskerne var i stand til at forbedre opløsningen væsentligt. Kredit:Diamond lyskilde Et team fra Cape Town -
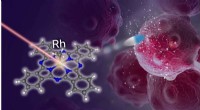 Radikalt nyt behandlingssystem lyser op i kræftbehandlingForskere fra Institute of Industrial Science, University of Tokyo har udviklet et strømlinet foto-uncaging-system til fotodynamisk cancerterapi, ved hjælp af en lyspuls til tumorspecifik aktivering af
Radikalt nyt behandlingssystem lyser op i kræftbehandlingForskere fra Institute of Industrial Science, University of Tokyo har udviklet et strømlinet foto-uncaging-system til fotodynamisk cancerterapi, ved hjælp af en lyspuls til tumorspecifik aktivering af
- Hvad er kogepunktet for vand 100,00 grader celsius, når et tilsat opløst stof stiger til 0,75?
- Hvilke Fjender Har Raccoons Har?
- Ny rapport fremhæver, hvordan droner kan bruges til gavn for samfundet
- Ældre iværksættere lige så succesfulde som deres yngre kolleger, undersøgelse afslører
- Måling af forbedring i design af pulser til kvantesystemer
- Rekonfigurerbar chiral mikrolaser ved spontan symmetribrud


