Hvad er kogepunktet for vand 100,00 grader celsius, når et tilsat opløst stof stiger til 0,75?
$$\Delta T_b =K_b \cdot m$$
hvor $\Delta T_b$ er kogepunktshøjden, $K_b$ er opløsningsmidlets kogepunktshøjdekonstant, og $m$ er opløsningens molalitet.
For vand er kogepunktets højdekonstanten $K_b =0,512 \grader\tekst{C/m}$. Hvis vands kogepunkt stiger til $0,75 \degree\text{C}$, når et opløst stof tilsættes, så er opløsningens molalitet:
$$m =\frac{\Delta T_b}{K_b} =\frac{0,75 \degree\text{C}}{0,512 \degree\text{C/m}} =1,46 \text{ m}$$
Derfor stiger vands kogepunkt til $100,75 \degree\text{C}$, når der tilsættes et opløst stof, der øger opløsningens molalitet til $1,46 \text{ m}$.
 Varme artikler
Varme artikler
-
 Blandingsregler for 3-D printknogleKredit:Pixabay/CC0 Public Domain Ved at kombinere syntetiske polymerer og naturlige materialer er det muligt at øge rækken af egenskaber, der kan fremstilles ved hjælp af 3-D-print af komponente
Blandingsregler for 3-D printknogleKredit:Pixabay/CC0 Public Domain Ved at kombinere syntetiske polymerer og naturlige materialer er det muligt at øge rækken af egenskaber, der kan fremstilles ved hjælp af 3-D-print af komponente -
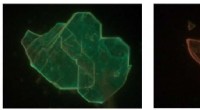 Kamæleonmaterialer:Oprindelsen af farvevariation i lavdimensionelle perovskitterBredfeltsfotoluminescensmikrofotografier (230_175 μm) viser, hvordan nogle Perovskite-flager ser lysegrønne ud over hele deres område (venstre panel), mens andre flager udviser en tydeligt rødforskudt
Kamæleonmaterialer:Oprindelsen af farvevariation i lavdimensionelle perovskitterBredfeltsfotoluminescensmikrofotografier (230_175 μm) viser, hvordan nogle Perovskite-flager ser lysegrønne ud over hele deres område (venstre panel), mens andre flager udviser en tydeligt rødforskudt -
 Ny elektronisk enhed registrerer eksplosive dampeKredit:National Research Nuclear University Forskere fra National Research Nuclear University MEPhI (Rusland) har præsenteret en detektor, der kan skelne lugte bedre end en servicehund. En lille e
Ny elektronisk enhed registrerer eksplosive dampeKredit:National Research Nuclear University Forskere fra National Research Nuclear University MEPhI (Rusland) har præsenteret en detektor, der kan skelne lugte bedre end en servicehund. En lille e -
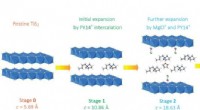 Gennembrud inden for magnesiumbatterier:Nanostruktureret katode, forståelse af ny elektrolyt fører…Skematisk over den strukturelle udvikling af titandisulfid på forskellige stadier af interkalation. Mellemlag udvides eller forvrænges som forskellige mængder af søjlemolekyler, komplekse kationer og
Gennembrud inden for magnesiumbatterier:Nanostruktureret katode, forståelse af ny elektrolyt fører…Skematisk over den strukturelle udvikling af titandisulfid på forskellige stadier af interkalation. Mellemlag udvides eller forvrænges som forskellige mængder af søjlemolekyler, komplekse kationer og
- Indonesien-ekspert advarede om jordskælv, regeringens kortlagte risikoområder
- Hvad sker der, når sukker røres ud i vand?
- Sagrada Familia Basilica er næsten færdig,
- Høj effektivitet, billig katalysator til vandelektrolyse
- 5 sjove genbrugsprojekter for hele familien
- Rumstationsforsyninger lanceret med en pizzalevering til 7


