Hvor mange mol zn forbruges, når 1,60 x 1024 molekyler hcl reagerer fuldstændigt i følgende ligning plus 2hcl er lig med zncl2 h2?
Zn + 2HCl → ZnCl2 + H2
Ud fra den afbalancerede ligning kan vi se, at 1 mol Zn reagerer med 2 mol HCl. Så hvis 1,60 x 1024 molekyler HCl reagerer, kan vi beregne de tilsvarende mol HCl:
Mol HCl =(1,60 x 1024 molekyler HCl) / (6,022 x 1023 molekyler/mol) ≈ 0,266 mol HCl
Da 1 mol Zn reagerer med 2 mol HCl, kan vi bestemme mol Zn forbrugt:
Mol Zn =(0,266 mol HCl) / (2 mol HCl/mol Zn) ≈ 0,133 mol Zn
Derfor forbruges cirka 0,133 mol Zn, når 1,60 x 1024 molekyler HCl reagerer fuldstændigt i den givne ligning.
 Varme artikler
Varme artikler
-
 Forskere udvikler biofornybar, bionedbrydeligt plastKredit:CC0 Public Domain Forskere Haritz Sardón, Ainara Sangroniz og Agustin Etxeberria ved UPV/EHUs kemiske fakultet, sammen med forskerne Eugene Y.-X. Chen, Jian-Bo Zhu og Xiaoyan Tang ved Color
Forskere udvikler biofornybar, bionedbrydeligt plastKredit:CC0 Public Domain Forskere Haritz Sardón, Ainara Sangroniz og Agustin Etxeberria ved UPV/EHUs kemiske fakultet, sammen med forskerne Eugene Y.-X. Chen, Jian-Bo Zhu og Xiaoyan Tang ved Color -
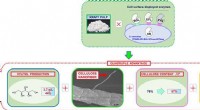 Fremstilling af xylitol og cellulose nanofibre af papirpasta – mod et grønt og bæredygtigt samfundFigur 1. Den firdobbelte fordel ved brug af modificeret gær Den økologiske bioproduktion af xylitol og cellulose nanofibre ved hjælp af modificerede gærceller, fra materiale produceret af papirind
Fremstilling af xylitol og cellulose nanofibre af papirpasta – mod et grønt og bæredygtigt samfundFigur 1. Den firdobbelte fordel ved brug af modificeret gær Den økologiske bioproduktion af xylitol og cellulose nanofibre ved hjælp af modificerede gærceller, fra materiale produceret af papirind -
 Forskere fanger molekylære kort over dyrevæv med hidtil usete detaljerDon Smith er medlem af forskningsfakultetet ved National High Magnetic Field Laboratory. Kredit:Stephen Bilenky Vi har alle hørt, og set, hvordan et billede tegner tusind ord. Nu, i en videnskabel
Forskere fanger molekylære kort over dyrevæv med hidtil usete detaljerDon Smith er medlem af forskningsfakultetet ved National High Magnetic Field Laboratory. Kredit:Stephen Bilenky Vi har alle hørt, og set, hvordan et billede tegner tusind ord. Nu, i en videnskabel -
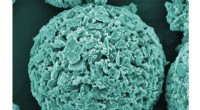 Nye materialer og processer til at rense patogene mikroorganismer fra vandEmpa -forskere udvikler nye filtersystemer fremstillet af kompositmaterialer såsom keramiske granulater med en kobber -nanokoating som afbildet her (elektronmikroskopi, farvet). Kredit:Sena Yüzbasi /
Nye materialer og processer til at rense patogene mikroorganismer fra vandEmpa -forskere udvikler nye filtersystemer fremstillet af kompositmaterialer såsom keramiske granulater med en kobber -nanokoating som afbildet her (elektronmikroskopi, farvet). Kredit:Sena Yüzbasi /
- MUSE afslører en glødende ring af lys i det fjerne univers
- Klar til at ryste? Arktisk luft lagde Amerika på is
- Hvilke af egenskaberne har lithium en større værdi end kalium?
- Usædvanlige oversvømmelser i det østlige Congo forårsager nød for næsten en halv million menne…
- De molekyler, der omdanner ekstracellulære signaler til intracellulære, er?
- Milliardærer køber medier:Frelsers kompleks eller borgerpligt?


