Når atomer kombineres med andre interaktioner mellem deres?
1. Elektrondeling (kovalent binding):
Når atomer kombineres for at danne en kovalent binding, overlapper deres atomare orbitaler, og elektroner deles mellem de deltagende atomer. Denne deling af elektroner fører til dannelsen af molekylære orbitaler, som beskriver fordelingen og opførselen af elektroner i molekylet.
2. Elektronoverførsel (ionisk binding):
Ved ionbinding overføres en eller flere elektroner fra et atom til et andet, hvilket resulterer i dannelsen af positivt ladede ioner (kationer) og negativt ladede ioner (anioner). Den elektrostatiske tiltrækning mellem disse modsat ladede ioner holder den ioniske forbindelse sammen.
3. Metallisk binding:
Metallisk binding sker i metaller, hvor de yderste elektroner (valenselektroner) holdes løst af deres respektive kerner. Disse valenselektroner er delokaliserede og kan bevæge sig frit gennem metalgitteret. Tiltrækningen mellem de positivt ladede metalioner og havet af delokaliserede elektroner holder metalstrukturen sammen.
4. Hydrogenbinding:
Hydrogenbinding er en stærk dipol-dipol-interaktion, der forekommer mellem et hydrogenatom, der er kovalent bundet til et elektronegativt atom (såsom N, O eller F) og et andet stærkt elektronegativt atom. Det involverer den delvise positive ladning af hydrogenatomet tiltrukket af den delvise negative ladning af det elektronegative atom.
5. van der Waals styrker:
van der Waals-kræfter er svage intermolekylære kræfter, der inkluderer dipol-dipol-interaktioner, London-spredningskræfter og inducerede dipol-dipol-interaktioner. Disse kræfter skyldes de midlertidige udsving i elektronfordelingen i molekyler.
Den type interaktion, der opstår mellem atomer ved kombination, afhænger primært af elektronegativitetsforskellen mellem atomerne og de elektroniske konfigurationer af de deltagende atomer. Disse interaktioner bestemmer den resulterende kemiske forbindelses molekylære struktur, egenskaber og adfærd.
 Varme artikler
Varme artikler
-
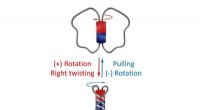 Alle afviklede:En reversibel molekylær hvirvelDenne molekylære hvirvel kan vrides reversibelt, og forskere kan måle dens kræfter. Kredit:Tilpasset fra Journal of the American Chemical Society (2022), DOI:10.1021/jacs.2c02547 I løbet af de sids
Alle afviklede:En reversibel molekylær hvirvelDenne molekylære hvirvel kan vrides reversibelt, og forskere kan måle dens kræfter. Kredit:Tilpasset fra Journal of the American Chemical Society (2022), DOI:10.1021/jacs.2c02547 I løbet af de sids -
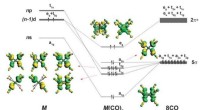 Kemikere viser, at 18-elektronprincippet ikke er begrænset til overgangsmetallerBindingsskema og form af de besatte valensorbitaler af M(CO) 8 (M =Ca, Sr, eller Ba). Opdeling af spd -valensorbitalerne i et atom M med konfigurationen (n - 1) d 2 ns 0 np 0 i oktakoordinatku
Kemikere viser, at 18-elektronprincippet ikke er begrænset til overgangsmetallerBindingsskema og form af de besatte valensorbitaler af M(CO) 8 (M =Ca, Sr, eller Ba). Opdeling af spd -valensorbitalerne i et atom M med konfigurationen (n - 1) d 2 ns 0 np 0 i oktakoordinatku -
 Gennembrud skabt ved påvisning af kulstof -urenheder i galliumnitridkrystaller via lysGaN-krystaller under foto-excitation. Kulstofkoncentration fra venstre mod højre:høj, medium, og lav. Kredit:Kazunobu Kojima Kulstofrenhed har længe hindret effektiviteten i nitridbaserede elektro
Gennembrud skabt ved påvisning af kulstof -urenheder i galliumnitridkrystaller via lysGaN-krystaller under foto-excitation. Kulstofkoncentration fra venstre mod højre:høj, medium, og lav. Kredit:Kazunobu Kojima Kulstofrenhed har længe hindret effektiviteten i nitridbaserede elektro -
 3-D-print af grønnere bygninger ved hjælp af lokal jordForskere har udviklet en metode til at 3D-printe strukturer ved hjælp af lokal jord. Kredit:Aayushi Bajpayee Byggebranchen står i øjeblikket over for to store udfordringer:efterspørgslen efter bær
3-D-print af grønnere bygninger ved hjælp af lokal jordForskere har udviklet en metode til at 3D-printe strukturer ved hjælp af lokal jord. Kredit:Aayushi Bajpayee Byggebranchen står i øjeblikket over for to store udfordringer:efterspørgslen efter bær
- Forskere foreslår at ændre historiens regler for at undgå miljøsammenbrud
- Farerne ved forkert tilpassede produktudviklingskontrakter, og hvordan de kan afspore innovation i h…
- Svaghed er god ... når lyset kontrolleres
- Forebyggelse af scrollers anger:Sådan ved du, hvad brugerne vil have
- Bitcoin bedre end dollaren?
- Faldende tillid til fakta, institutioner pålægger det amerikanske samfund omkostninger i den virke…


