Hvad er usædvanligt ved atomstruktur?
* for det meste tomt rum: Atomer er primært tomme rum. Kernen, der indeholder protoner og neutroner, er utroligt lille sammenlignet med det rum, der er besat af de elektroner, der kredser om det. Hvis et atom var på størrelse med et fodboldstadion, ville kernen være på størrelse med en ærter i midten.
* kvantemekanik: Elektroner kredser ikke kernen som planeter omkring en sol. I stedet findes de i uklar, sandsynlighedsbaserede regioner kaldet orbitaler, styret af kvantemekanikens love. Dette betyder, at vi ikke kan finde ud af en elektrons nøjagtige placering, kun sandsynligheden for at finde det i et bestemt område.
* bølgepartikel dualitet: Elektroner udviser både bølge-lignende og partikellignende opførsel. De kan handle som bølger, diffraktion og forstyrrende, men også som partikler med en defineret masse og ladning.
* Kvantiserede energiniveau: Elektroner i et atom kan kun besætte specifikke energiniveauer, ikke kun nogen energi. De kan "hoppe" mellem disse niveauer ved at absorbere eller frigive energi. Denne kvantiserede karakter forklarer, hvorfor atomer udsender og absorberer lys ved specifikke bølgelængder, hvilket fører til det karakteristiske spektrum for hvert element.
* Usikkerhedsprincip: Det berømte Heisenberg -usikkerhedsprincip siger, at vi ikke kan kende både positionen og momentumet for et elektron med absolut sikkerhed. Jo mere præcist vi kender en, jo mindre præcist kan vi kende den anden.
* stabilitet og ustabilitet: Mens de fleste atomer er stabile, er isotoper af nogle elementer radioaktive, hvilket betyder, at deres kerner er ustabile og forfald over tid og frigiver energi og partikler. Dette radioaktive forfald er grundlaget for atomkraft og forskellige medicinske anvendelser.
Disse aspekter af atomstruktur udfordrer vores daglige intuition om, hvordan ting fungerer, hvilket fører til kvanteverdenens modintuitive karakter. Det er et fascinerende felt, der fortsætter med at blive udforsket og forstået.
 Varme artikler
Varme artikler
-
 Forskere gør fremskridt inden for afsaltningsteknologiIllinois mekanik- og ingeniørprofessor Kyle Smith og hans medforfattere har vist, at en ny batterylignende vandafsaltningsanordning kunne hjælpe med at levere ferskvand til en række forskellige område
Forskere gør fremskridt inden for afsaltningsteknologiIllinois mekanik- og ingeniørprofessor Kyle Smith og hans medforfattere har vist, at en ny batterylignende vandafsaltningsanordning kunne hjælpe med at levere ferskvand til en række forskellige område -
 MOF holder luftfugtigheden i Goldilocks -zonenFigurtekst/kredit:Når den relative luftfugtighed stiger, MOF går fra tør (yderst til venstre) til fuldstændigt fyldt med vandmolekyler (yderst til højre); vandmolekyler vist med blåt. Kredit:American
MOF holder luftfugtigheden i Goldilocks -zonenFigurtekst/kredit:Når den relative luftfugtighed stiger, MOF går fra tør (yderst til venstre) til fuldstændigt fyldt med vandmolekyler (yderst til højre); vandmolekyler vist med blåt. Kredit:American -
 Forskere ser på meteoritter for at få inspiration til at opnå kritiske elementfri magnetThe Critical Materials Institute har udviklet en billig, højtydende permanentmagnet ved at hente inspiration fra en kilde, der ikke er af denne verden:jern-nikkel-legeringer i meteoritter. Kredit:U.S.
Forskere ser på meteoritter for at få inspiration til at opnå kritiske elementfri magnetThe Critical Materials Institute har udviklet en billig, højtydende permanentmagnet ved at hente inspiration fra en kilde, der ikke er af denne verden:jern-nikkel-legeringer i meteoritter. Kredit:U.S. -
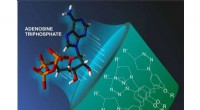 Fælder for energikildemolekyler i cellerKredit:Natalia Deryugina Et team af forskere, inklusive en RUDN-kemiker, har syntetiseret nye molekyler, der tilhører klassen af calixarener, skållignende hule strukturer. Disse stoffer ser ud t
Fælder for energikildemolekyler i cellerKredit:Natalia Deryugina Et team af forskere, inklusive en RUDN-kemiker, har syntetiseret nye molekyler, der tilhører klassen af calixarener, skållignende hule strukturer. Disse stoffer ser ud t
- Ny forskning identificerer to typer tørke i hele Kina, og hvordan de udvikler sig
- Sådan konverteres UG /mL til PPM
- De første resultater af satellitovervågning over havniveau overgår forventningerne
- Mestring af fremtidens elnet
- Hvordan er jordlitosfæren relateret til skorpen?
- Forskning viser, at protein på de indfødte græsarealer i USA er i tilbagegang


