Er overskydende natriumhydroxidopløselig i vand?
Her er hvorfor:
* NaOH er en stærk base: Det adskiller sig let i vand og danner natriumioner (Na+) og hydroxidioner (OH-).
* opløselighed øges med temperatur: Mens NaOH er meget opløselig ved stuetemperatur, øges dens opløselighed markant, når vandtemperaturen stiger.
Der er dog nogle praktiske begrænsninger:
* Mætningspunkt: Selvom NaOH er meget opløselig, er der en grænse for, hvor meget der kan opløses i en given mængde vand ved en bestemt temperatur. Dette er kendt som mætningspunktet. Ud over dette punkt opløses enhver yderligere NaOH ikke.
* eksotermisk reaktion: Opløsning af NaOH i vand er en eksoterm reaktion, hvilket betyder, at den frigiver varme. Hvis du tilføjer for meget NaOH, kan løsningen blive meget varm, hvilket potentielt kan forårsage farer.
Derfor, mens overskydende NaOH kan opløses i vand, er det vigtigt at overveje mætningspunktet og sikkerhedsforholdsreglerne, når man håndterer store mængder.
 Varme artikler
Varme artikler
-
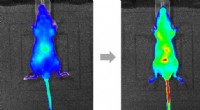 C-vitamin i kroppen kan spores ved fluorescensMusene blev injiceret med en dosis ekstra C-vitamin, hæve koncentrationen over det normale. Sondesignalet spredte sig over hele kroppen over en time, bliver særligt intens i vitale organer. Det er før
C-vitamin i kroppen kan spores ved fluorescensMusene blev injiceret med en dosis ekstra C-vitamin, hæve koncentrationen over det normale. Sondesignalet spredte sig over hele kroppen over en time, bliver særligt intens i vitale organer. Det er før -
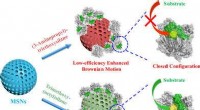 Enzymkonformation påvirker ydeevnen af lipase-drevne nanomotorerKredit:Angewandte Chemie En undersøgelse foretaget af forskere ved Centro Nacional de Investigaciones Cardiovasculares (CNIC), Universidad Complutense (UCM), Universidad de Girona (UdG), og Instit
Enzymkonformation påvirker ydeevnen af lipase-drevne nanomotorerKredit:Angewandte Chemie En undersøgelse foretaget af forskere ved Centro Nacional de Investigaciones Cardiovasculares (CNIC), Universidad Complutense (UCM), Universidad de Girona (UdG), og Instit -
 Højtydende elektrokatalysatorer til at drive udviklingen af direkte ethanolbrændselscellerKombinerer kerne-skal-konstruktion med en legeringseffekt for at øge palladiums katalytiske ydeevne i ethanoloxidationsreaktioner. Kredit:YANG Jun Forskere fra Institute of Process Engineering (IP
Højtydende elektrokatalysatorer til at drive udviklingen af direkte ethanolbrændselscellerKombinerer kerne-skal-konstruktion med en legeringseffekt for at øge palladiums katalytiske ydeevne i ethanoloxidationsreaktioner. Kredit:YANG Jun Forskere fra Institute of Process Engineering (IP -
 Faraday stoffer? MXene-belagt stof kan indeholde elektronisk interferens i bærbare enhederDrexel University-forskere rapporterer, at stof belagt med MXene er 99,9 % effektivt til at blokere elektromagnetisk interferens. Kredit:Drexel University Forskere ved Drexel Universitys College o
Faraday stoffer? MXene-belagt stof kan indeholde elektronisk interferens i bærbare enhederDrexel University-forskere rapporterer, at stof belagt med MXene er 99,9 % effektivt til at blokere elektromagnetisk interferens. Kredit:Drexel University Forskere ved Drexel Universitys College o
- Hvilke 5 typer forurening?
- Hvad kolde firben i Miami kan fortælle os om modstandsdygtighed over for klimaændringer
- Hvilke stjernebilleder passerer ekliptikken igennem?
- 5 Betydningen af fysik i din daglige liv?
- Næringsstofgenbrugsmikrober kan føle varmen
- Hvordan kan du ødelægge den videnskabelige lov?


