Hvorfor glød lyspæren mere lyst, når elektroder er nedsænket i opløsning af HCL og NaOH, så eddike?
Forståelse af ledningsevne
* Elektricitet og ioner: Elektricitet strømmer gennem et kredsløb ved bevægelse af ladede partikler kaldet ioner. I opløsninger oprettes disse ioner, når stoffer opløses, og deres molekyler går i stykker i ladede komponenter.
* stærk vs. svage elektrolytter: Nogle stoffer, som stærke syrer (HCI) og stærke baser (NaOH), ioniseres fuldstændigt i vand, hvilket betyder, at de producerer en høj koncentration af ioner. Disse kaldes stærke elektrolytter. Eddike, som er en svag syre (eddikesyre), ioniserer kun delvist, hvilket betyder, at den har en meget lavere koncentration af ioner.
eksperimentet
Når du fordyber elektroder i disse løsninger, sker følgende:
1. HCL og NAOH: Disse stærke elektrolytter tilvejebringer en høj koncentration af ioner. Når den er tilsluttet et kredsløb, bærer ionerne let den elektriske strøm, hvilket tillader en betydelig mængde elektricitet at strømme gennem opløsningen og strømmen pæren, hvilket gør den glød lyst.
2. eddike: Fordi eddike kun delvist ioniserer, har den en meget lavere koncentration af ioner. Færre ioner til rådighed for at bære de nuværende betyder mindre elektricitetsstrømme gennem opløsningen, hvilket resulterer i en dæmpere pære.
Kortfattet
Lyspærens lysstyrke korrelerer direkte med ledningsevnen af opløsningen. Stærke elektrolytter (som HCI og NaOH) har høj ledningsevne på grund af deres høje ionkoncentration, hvilket fører til et skarpt lys. Svage elektrolytter (som eddike) har lavere ledningsevne, hvilket resulterer i et svage lys.
Sidste artikelHvem har den stærkere dipol-dipolhydrogenchlorid eller melid?
Næste artikelEr overskydende natriumhydroxidopløselig i vand?
 Varme artikler
Varme artikler
-
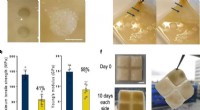 Selvhelbredende levende materialer brugt som 3D byggeklodserForskere så fremragende reparation, der var strukturelt stabil og genoprettede materialets konsistens og udseende. Kredit:Imperial College London Imperial College London-forskere har skabt 3D-bygg
Selvhelbredende levende materialer brugt som 3D byggeklodserForskere så fremragende reparation, der var strukturelt stabil og genoprettede materialets konsistens og udseende. Kredit:Imperial College London Imperial College London-forskere har skabt 3D-bygg -
 Bananskræller gør sukkerkager bedre for digKredit:Unsplash/CC0 Public Domain Bananskræller er ikke altid bestemt til skraldespanden eller komposten længere. De er på vej ind på folks tallerkener, erstatter svinekød i pulled peel sandwich og
Bananskræller gør sukkerkager bedre for digKredit:Unsplash/CC0 Public Domain Bananskræller er ikke altid bestemt til skraldespanden eller komposten længere. De er på vej ind på folks tallerkener, erstatter svinekød i pulled peel sandwich og -
 Hvordan forlænger man smøremidlernes brugstid?Uanset om det er i din bil eller en vindmølle, skum nedbryder det smøremiddel, der er nødvendigt for, at motorer kan arbejde effektivt. Kredit:Pixabay/phtorxp Vindmøller, der rager flere hundrede
Hvordan forlænger man smøremidlernes brugstid?Uanset om det er i din bil eller en vindmølle, skum nedbryder det smøremiddel, der er nødvendigt for, at motorer kan arbejde effektivt. Kredit:Pixabay/phtorxp Vindmøller, der rager flere hundrede -
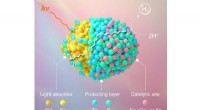 Voksende aktive steder på kvanteprikker til robust brintfotogenereringSkematisk diagram over sted- og rumligt-selektiv integration af metalioner i QDer for robust H 2 fotogenerering. Kredit:Prof. WUs Group For ganske nylig, Kinesiske forskere havde opnået sted- og
Voksende aktive steder på kvanteprikker til robust brintfotogenereringSkematisk diagram over sted- og rumligt-selektiv integration af metalioner i QDer for robust H 2 fotogenerering. Kredit:Prof. WUs Group For ganske nylig, Kinesiske forskere havde opnået sted- og
- Eksempler på sekundære forurenende stoffer
- Zuckerberg lover at blive ved med at bygge en adresse uden undskyldning
- Forskning afslører forskelle mellem, hvordan mænd og kvinder konkurrerer mod hinanden
- Bekymret for dine Facebook-data?
- Hvorfor har natrium og klor så forskellige egenskaber, når de findes som elementer fra forbindelse…
- Små flasker og smeltende propper:Temperaturen regulerer det nye leveringssystem for medicin og duft…


