Hvilken har den stærkeste nitrogenbinding H2NNH2 eller HNNH?
Her er hvorfor:
* Hybridisering: I hydrazin er hvert nitrogenatom SP³ hybridiseret. Dette resulterer i en tetrahedral geometri omkring hvert nitrogen, hvor de ensomme par elektroner optager to af de fire sp³ orbitaler. Dette arrangement fører til en stærkere N-N-binding på grund af større overlapning af de hybridiserede orbitaler.
* Elektronegativitet: Begge nitrogenatomer i hydrazin har et ensomt par elektroner, hvilket bidrager til øget elektrondensitet og styrker N-N-bindingen.
* resonans: Diimid (HNNH) kan udvise resonans, der delokaliserer elektronerne og svækker N-N-bindingen. Resonansstrukturerne bidrager til en dobbeltbindingskarakter i diimid, men den enkeltbindingskarakter af N-N-bindingen i hydrazin gør det stærkere.
Kortfattet: Den større elektrondensitet, stærkere orbitale overlapning og mangel på resonans i hydrazin bidrager til dens stærkere N-N-binding sammenlignet med diimid.
Sidste artikelEn væske, der udvides, når den bliver koldere?
Næste artikelHvor mange atomer af hvert element i Caco3?
 Varme artikler
Varme artikler
-
 Team får indsigt i oxidlaget af rustfrit stålFra venstre, Lin Zhu, beamline videnskabsmand; Alexei Zakharov, MAXPEEM beamline manager; Axel Knutsson, Materialespecialist hos Alfa Laval; Oskar Darselius Berg, Alfa Laval. Kredit:Lunds Universitet
Team får indsigt i oxidlaget af rustfrit stålFra venstre, Lin Zhu, beamline videnskabsmand; Alexei Zakharov, MAXPEEM beamline manager; Axel Knutsson, Materialespecialist hos Alfa Laval; Oskar Darselius Berg, Alfa Laval. Kredit:Lunds Universitet -
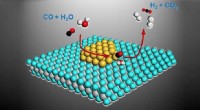 Forskere rykker tættere på brintdrevne bilerEn international forskergruppe, herunder materialeforskere fra Lehigh, har udviklet en guldbaseret katalysator, der omdanner kulilte og vand til en strøm af ren brint og kuldioxid. Kredit:Ding Ma/Peki
Forskere rykker tættere på brintdrevne bilerEn international forskergruppe, herunder materialeforskere fra Lehigh, har udviklet en guldbaseret katalysator, der omdanner kulilte og vand til en strøm af ren brint og kuldioxid. Kredit:Ding Ma/Peki -
 Magnetiske bakterier som mikropumperKredit:Unsplash/CC0 Public Domain ETH-forskere bruger magnetiske bakterier til at kontrollere væsker på mikroniveau. De overvejer allerede at bruge dem i den menneskelige blodbane til præcis lever
Magnetiske bakterier som mikropumperKredit:Unsplash/CC0 Public Domain ETH-forskere bruger magnetiske bakterier til at kontrollere væsker på mikroniveau. De overvejer allerede at bruge dem i den menneskelige blodbane til præcis lever -
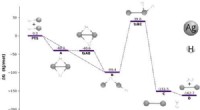 Kvantekemikere fremmaner opskrift til at blive guld, sølv og kobber i beholdere med grøn energiGratis energiprofil for reaktionen, der involverer AgH -monomerer. D svarer til Ag2- og H2 -molekylerne ved dissociationsgrænsen. Alle de frie energier (i kJ ⋅ mol − 1) blev opnået ved MP2/aug-cc-pVQZ
Kvantekemikere fremmaner opskrift til at blive guld, sølv og kobber i beholdere med grøn energiGratis energiprofil for reaktionen, der involverer AgH -monomerer. D svarer til Ag2- og H2 -molekylerne ved dissociationsgrænsen. Alle de frie energier (i kJ ⋅ mol − 1) blev opnået ved MP2/aug-cc-pVQZ
- Hvordan lactoferrin klemmer ned på frit omstrejfende jernioner for at stoppe skadelige virkninger p…
- Hvilken organel af en celle er hvor sukker er nedbrudt?
- Skurepulver indeholder enten kvarts eller?
- Nanopartikler kan hjælpe forskere med at lysne deres forskning - men de kan også kaste mikroskopis…
- Hvordan fremstilles en bane?
- Hvad er massens centrum på en raket?


