Hvordan lactoferrin klemmer ned på frit omstrejfende jernioner for at stoppe skadelige virkninger på celler
Det, der forhindrer vores celler i at blive overeksponeret for jernioner, der strejfer frit rundt i kroppen, er et protein kaldet lactoferrin, kendt for sin evne til at binde tæt til sådanne ioner. Disse frie ioner er essentielle for en række biologiske processer. Hvis fundet i for store mængder, imidlertid, de kan forårsage skade på proteiner og DNA i kroppen, nogle gange endda fører til celledød. Dette skyldes, at frie jernioner fører til en stigning i koncentrationen af reaktive stoffer med oxidationskraft, der bevæger sig frit i kroppen. Dette har drevet videnskabsmænd til at udvikle en bedre forståelse af, hvordan lactoferrins strukturelle ændring hjælper med at presse frie jernioner ned.
I en ny undersøgelse offentliggjort i EPJ E , Lilia Anghel fra Institute of Chemistry i Chisinau, Republikken Moldova, og forskningssamarbejdspartnere studerer ændringerne i strukturen af lactoferrin, da det binder sig til jernioner, ved hjælp af kombinerede eksperimentelle og molekylære dynamiksimuleringer.
Forskere, der tidligere har studeret røntgenkrystalstrukturen af humant lactoferrin, har vist, at ændringer i konformationen i proteinstrukturen opstår, når jernionen binder sig til den. I dette studie, forfatterne er afhængige af en metode kaldet small angle neutron scattering til at detektere de strukturelle forskelle mellem den åbne og lukkede konformation af humant lactoferrin i opløsning.
Forfatterne viser, at en aminosyre - nemlig Arginin 121 - spiller en nøglerolle i konformationsstabiliteten af lactoferrinproteinet. Ud over, ved at fokusere på at forstå, hvordan humant lactoferrin ændrer sig fra dets åbne til dets lukkede konformation, de finder også, at den åbne konformation ser ud til at tilbyde en mindre snoningsradius end den for den lukkede version.
Til sidst, de registrerer synlige forskelle mellem de to lav opløsning, tredimensionelle modeller af åben og lukket struktur af humant lactoferrin i opløsning. Begge har en mere kompakt konformation end højopløsningsstrukturer.
 Varme artikler
Varme artikler
-
 Hvad er tilskuerioner?Tilskuereioner er ioner, der findes i en opløsning, men ikke deltager i en opløsnings kemiske reaktion. Når reaktanter dissocieres til ioner, kan nogle af ionerne kombineres og danne en ny forbindelse
Hvad er tilskuerioner?Tilskuereioner er ioner, der findes i en opløsning, men ikke deltager i en opløsnings kemiske reaktion. Når reaktanter dissocieres til ioner, kan nogle af ionerne kombineres og danne en ny forbindelse -
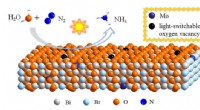 Forbedret omgivende ammoniakfotosyntese ved hjælp af nanosheets med lysomskiftelige iltpladserForskere har præsenteret en strategi ved samtidig at introducere lysomskiftelig ilt-ledighed og dopingmo i Bi 5 O 7 Br nanosheets til effektivt fotokatalytisk N 2 fiksering. Den modificerede fot
Forbedret omgivende ammoniakfotosyntese ved hjælp af nanosheets med lysomskiftelige iltpladserForskere har præsenteret en strategi ved samtidig at introducere lysomskiftelig ilt-ledighed og dopingmo i Bi 5 O 7 Br nanosheets til effektivt fotokatalytisk N 2 fiksering. Den modificerede fot -
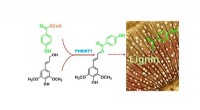 Forskere ID -enzym til fremstilling af nøgleindustrielt kemikalie i planterBrookhaven Lab-forskere identificerede et enzym (PHBMT1), der overfører p-hydoxybenzoat (grønt) til lignin-byggesten i poppel. Det resulterende konjugat inkorporeres derefter i den spirende ligninpoly
Forskere ID -enzym til fremstilling af nøgleindustrielt kemikalie i planterBrookhaven Lab-forskere identificerede et enzym (PHBMT1), der overfører p-hydoxybenzoat (grønt) til lignin-byggesten i poppel. Det resulterende konjugat inkorporeres derefter i den spirende ligninpoly -
 Forskere får laver til at overvåge luftforureningLav. Kredit:MIPT Et MIPT-baseret hold af forskere har foreslået at analysere lavsammensætningen for at vurdere atmosfærisk luftkvalitet, når konventionelle overvågningsstationer ikke er tilgængeli
Forskere får laver til at overvåge luftforureningLav. Kredit:MIPT Et MIPT-baseret hold af forskere har foreslået at analysere lavsammensætningen for at vurdere atmosfærisk luftkvalitet, når konventionelle overvågningsstationer ikke er tilgængeli
- Nobelprisen i fysik uddeles
- Polarisering har stor indflydelse på elektroner, viser undersøgelse
- Den nemme måde at få et firkantet tilbud på
- Nanocellulose muliggør fremstilling af nye miljøvenlige materialer
- PANIC lander revolutionerer asteroidforskning
- Forudsigelse af udbrud ved hjælp af satellitter og matematik


