Hvad er forskellen mellem et ilt 16 atom og 18 atom?
Her er en sammenbrud:
* Oxygen-16: Dette er den mest almindelige isotop af ilt. Det har 8 protoner og 8 neutroner . Antallet af protoner definerer elementet (i dette tilfælde ilt), og summen af protoner og neutroner giver atommassenummeret.
* Oxygen-18: Dette er en mindre almindelig isotop af ilt. Det har 8 protoner (Samme som ilt-16) men 10 neutroner . Dette ekstra neutron tegner sig for det højere atommasseantal på 18.
I det væsentlige er begge isotoper stadig ilt, fordi de har det samme antal protoner (8). De adskiller sig imidlertid i deres neutronantal, hvilket fører til en anden atommasse.
Her er nogle yderligere punkter:
* isotoper: Atomer af det samme element med forskellige antal neutroner kaldes isotoper.
* overflod: Oxygen-16 er den mest rigelige isotop, der udgør ca. 99,76% af alt ilt fundet naturligt. Oxygen-18 er meget mindre rigelig, hvilket kun udgør ca. 0,2% af det naturlige ilt.
* anvendelser: Oxygen-18 bruges i forskellige videnskabelige applikationer, herunder:
* paleoclimatology: Undersøgelse af tidligere klimaer ved at analysere forholdet mellem ilt-18 og ilt-16 i iskerner og fossiler.
* Medicinsk forskning: Sporing af metaboliske processer og undersøgelse af vandbevægelse i kroppen.
Fortæl mig, hvis du har yderligere spørgsmål!
 Varme artikler
Varme artikler
-
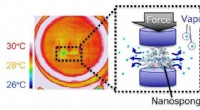 Udvikling af en ny type køling via kraftdrevet flydende gasovergangDen kølende effekt incused af sandwiched nanosvamp. Kredit:Hirotomo Nishihara Et forskerhold fra Tohoku University, Nissan Motor Co., Shinshu Universitet, og Okayama University gjorde en banebryde
Udvikling af en ny type køling via kraftdrevet flydende gasovergangDen kølende effekt incused af sandwiched nanosvamp. Kredit:Hirotomo Nishihara Et forskerhold fra Tohoku University, Nissan Motor Co., Shinshu Universitet, og Okayama University gjorde en banebryde -
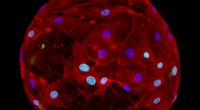 Gel dråber til regenerativ medicinCellebærende geler lavet af selvsamlende ultrakorte peptider kan producere menneskelignende væv, der kan bruges til regenerative terapier. Kredit:KAUST; Gustavo Ramirez Calderon Geldråber i mikrom
Gel dråber til regenerativ medicinCellebærende geler lavet af selvsamlende ultrakorte peptider kan producere menneskelignende væv, der kan bruges til regenerative terapier. Kredit:KAUST; Gustavo Ramirez Calderon Geldråber i mikrom -
 Softwarebibliotek til at tjene til hurtigere kemisk reaktionsbehandlingKredit:CC0 Public Domain Big Data er blevet allestedsnærværende i de senere år, og især i discipliner med heterogene og komplekse datamønstre. Dette gælder især for kemi. På nogle måder, kemiske f
Softwarebibliotek til at tjene til hurtigere kemisk reaktionsbehandlingKredit:CC0 Public Domain Big Data er blevet allestedsnærværende i de senere år, og især i discipliner med heterogene og komplekse datamønstre. Dette gælder især for kemi. På nogle måder, kemiske f -
 Forskere gengiver maleri i stor skala Great Wave med inkless teknologiRadical Inkless Technology producerer verdens mindste Ukiyo-e og lover at revolutionere vores udskrivning. Kredit:Kyoto University iCeMS Katsushika Hokusai (1760 - 1849) er titanen for japansk kun
Forskere gengiver maleri i stor skala Great Wave med inkless teknologiRadical Inkless Technology producerer verdens mindste Ukiyo-e og lover at revolutionere vores udskrivning. Kredit:Kyoto University iCeMS Katsushika Hokusai (1760 - 1849) er titanen for japansk kun
- Jagten på mørkt stof indsnævres af ny forskning
- Grafenfrakobling af organiske/uorganiske grænseflader
- Geofysiske observationer afslører vandfordelingen og effekten i Jordens kappe
- Sådan beregnes magten af numre
- Materialer med bindinger deler elektroner lige, mens de er ulige og har et dipolmoment?
- Orm,


