Materialer med bindinger deler elektroner lige, mens de er ulige og har et dipolmoment?
ikke -polære kovalente bindinger:
* elektroner deles lige: Atomerne, der er involveret i bindingen, har lignende elektronegativitet (evnen til at tiltrække elektroner). Dette betyder, at hverken Atom trækker de delte elektroner tættere på sig selv.
* Intet dipolmoment: Da elektronerne er fordelt jævnt, er der ingen adskillelse af ladning og derfor intet dipolmoment (et mål for adskillelsen af positive og negative ladninger).
polære kovalente bindinger:
* Elektroner deles ulige: Atomerne, der er involveret i bindingen, har forskellige elektronegativiteter. Atomet med højere elektronegativitet trækker de delte elektroner tættere, hvilket skaber en delvis negativ ladning på dette atom og en delvis positiv ladning på det andet atom.
* dipolmoment: Den ujævne fordeling af elektroner skaber en adskillelse af ladning, hvilket resulterer i et dipolmoment. Dette betyder, at molekylet har en positiv ende og en negativ ende.
Eksempler:
* ikke -polær: Et molekyle af ilt (O2) har en ikke -polær kovalent binding, fordi de to iltatomer har den samme elektronegativitet.
* polær: Et molekyle vand (H2O) har polære kovalente bindinger, fordi ilt er mere elektronegativt end brint, hvilket skaber en delvis negativ ladning på iltatomet og delvis positive ladninger på hydrogenatomerne.
Key Takeaway: Den lige eller ulige deling af elektroner i en kovalent binding bestemmer, om det er ikke -polært eller polært, med betydelige konsekvenser for molekylets samlede egenskaber.
Sidste artikelHvor mange valenselektroner har zink?
Næste artikelHvor skal molekylerne være ved start i fotosyntesen?
 Varme artikler
Varme artikler
-
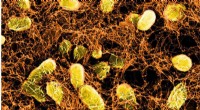 Probiotiske hydrogeler heler tarmsår, andre bandager ikke kan nåMikroskopisk billede af en bakteriel hydrogel, der binder til slimproteiner på overfladen af tarmvæggen. Kredit:Wyss Institute ved Harvard University Udvendige sår såsom hudsår eller hudafskrabn
Probiotiske hydrogeler heler tarmsår, andre bandager ikke kan nåMikroskopisk billede af en bakteriel hydrogel, der binder til slimproteiner på overfladen af tarmvæggen. Kredit:Wyss Institute ved Harvard University Udvendige sår såsom hudsår eller hudafskrabn -
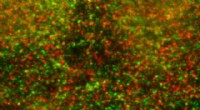 Hvordan celler genanvendes deres affaldsbortskaffelsessystemer for at fremme betændelseEndotelceller farvet med antistoffer til sporing af GPCR (vist med grønt) og E3 -ligase (vist med rødt) og påvist ved immunfluorescens konfokal mikroskopi. Kredit:UC San Diego Health G-proteinkobl
Hvordan celler genanvendes deres affaldsbortskaffelsessystemer for at fremme betændelseEndotelceller farvet med antistoffer til sporing af GPCR (vist med grønt) og E3 -ligase (vist med rødt) og påvist ved immunfluorescens konfokal mikroskopi. Kredit:UC San Diego Health G-proteinkobl -
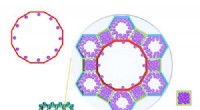 Realtidsanalyse af MOF-adsorptionsadfærdSkematisk illustration af molekyler adsorberet på metalorganiske rammer med forskellige porer af forskellige strukturer, hvor In-situ røntgenkrystallografi er blevet udviklet til at klassificere hver
Realtidsanalyse af MOF-adsorptionsadfærdSkematisk illustration af molekyler adsorberet på metalorganiske rammer med forskellige porer af forskellige strukturer, hvor In-situ røntgenkrystallografi er blevet udviklet til at klassificere hver -
 Undersøgelse afdækker ny hindring for udvikling af immunterapierBrian Baker, John A. Zahm, C.S.C., Professor i strukturbiologi og formand for Institut for Kemi og Biokemi Kredit:University of Notre Dame Kroppens immunsystem er et tappert våben mod sygdom, og u
Undersøgelse afdækker ny hindring for udvikling af immunterapierBrian Baker, John A. Zahm, C.S.C., Professor i strukturbiologi og formand for Institut for Kemi og Biokemi Kredit:University of Notre Dame Kroppens immunsystem er et tappert våben mod sygdom, og u
- Ny millisekund pulsar opdaget
- Hvorfor ville det at ændre den procentvise sammensætning af en krone fra 95 kobber til 97,5 zink g…
- Hvordan kan du lave en sten?
- Sådan finder du procentdelen af stigning i grafer
- Mikrobe-mysteriet løst:Hvad skete der med Deepwater Horizon-oliefanen
- Hvorfor er det mindre sandsynligt, at forbrugerne køber et produkt, når det er den eneste mulighed…


