Hvad er densiteten af CO2 -gas ved STP?
forståelse af koncepterne
* STP (standardtemperatur og tryk): 0 ° C (273,15 K) og 1 ATM -tryk.
* Ideel gaslov: PV =NRT, hvor:
* P =tryk
* V =volumen
* n =antal mol
* R =ideel gaskonstant (0,0821 l · atm/mol · k)
* T =temperatur
* densitet: Masse pr. Enhedsvolumen (ρ =m/v)
Beregninger
1. molmasse CO2: Den molære masse af CO2 er 44,01 g/mol (12,01 g/mol til carbon + 2 * 16,00 g/mol for ilt).
2. ved hjælp af den ideelle gaslov: Vi kan omarrangere den ideelle gaslov for at løse for volumen (v):
V =NRT/P.
3. erstatning for N (mol): Da densitet er masse pr. Volumen, kan vi udtrykke antallet af mol (N) som masse (M) divideret med molmasse (M):
n =m/m
Udskiftning af dette i volumenligningen:
V =(m/m) rt/p
4. omarrangering for densitet: Vi kan omarrangere volumenligningen for at løse for densitet (ρ =m/v):
ρ =(m/v) =(pm)/(rt)
5. tilslutning af værdier: Nu tilslutter vi værdierne for CO2 på STP:
ρ =(1 atm * 44,01 g/mol)/(0,0821 l · atm/mol · K * 273,15 K)
6. Beregning af densiteten:
ρ ≈ 1,96 g/l
Derfor er densiteten af CO2 -gas ved STP ca. 1,96 g/l.
Sidste artikelHvad er prik- og krydsdiagrammet for carbonylchlorid?
Næste artikelEr H2O en forbindelse eller blanding?
 Varme artikler
Varme artikler
-
 Innovative transistorer baseret på magnetisk induceret bevægelse af ionerKredit:National Institute for Materials Science Ligesom magneter tiltrækker jernpartikler i sandkasser, permanent magnetik tiltrækker kun én type ion i en elektrokemisk opløsning, udgør grundlaget
Innovative transistorer baseret på magnetisk induceret bevægelse af ionerKredit:National Institute for Materials Science Ligesom magneter tiltrækker jernpartikler i sandkasser, permanent magnetik tiltrækker kun én type ion i en elektrokemisk opløsning, udgør grundlaget -
 Perovskites – fremtidens materialer i optisk kommunikationFilmen i den nye perovskite overfører både tekst og billeder, hurtigt og pålideligt. Kredit:Thor Balkhed Forskere ved universiteterne i Linköping og Shenzhen har vist, hvordan en uorganisk perovsk
Perovskites – fremtidens materialer i optisk kommunikationFilmen i den nye perovskite overfører både tekst og billeder, hurtigt og pålideligt. Kredit:Thor Balkhed Forskere ved universiteterne i Linköping og Shenzhen har vist, hvordan en uorganisk perovsk -
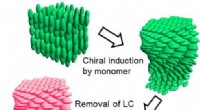 Metode til at skabe optisk aktive polymerer ved hjælp af en spiralformet flydende krystalskabelonGrafisk abstrakt. Kredit:Molekylære krystaller og flydende krystaller (2022). DOI:10.1080/15421406.2022.2073421 En videnskabsmand fra Fakultetet for Rene og Anvendte Videnskaber ved University of T
Metode til at skabe optisk aktive polymerer ved hjælp af en spiralformet flydende krystalskabelonGrafisk abstrakt. Kredit:Molekylære krystaller og flydende krystaller (2022). DOI:10.1080/15421406.2022.2073421 En videnskabsmand fra Fakultetet for Rene og Anvendte Videnskaber ved University of T -
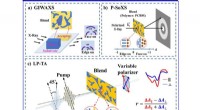 Undersøgelse af molekylær orientering ved polarisationsselektiv forbigående absorptionsspektrosko…Skematisk diagram over (a) GIWAXS, (b) P-SoXS og (c) LP-TA. Kredit:©Science China Press Den organiske solcelle (OSC) heterojunction -grænseflade er, hvor centrale fotofysiske processer som ladning
Undersøgelse af molekylær orientering ved polarisationsselektiv forbigående absorptionsspektrosko…Skematisk diagram over (a) GIWAXS, (b) P-SoXS og (c) LP-TA. Kredit:©Science China Press Den organiske solcelle (OSC) heterojunction -grænseflade er, hvor centrale fotofysiske processer som ladning
- Effekten af kuld på miljøet og dyr
- Anvendte fysikere skaber byggesten til en ny klasse af optiske kredsløb
- Hvad har den største indflydelse på potentiel energi på et objekt?
- Kan et jernatom være i stand til at udføre varme?
- Kommer Tidal Energy fra solen?
- Hvor ville du være, hvis du var på 0 grader længdegrad og 50 nord?


