Hvad er prik- og krydsdiagrammet for carbonylchlorid?
1. Bestem valenselektronerne
* carbon (c): 4 valenselektroner
* ilt (O): 6 Valenselektroner
* klor (Cl): 7 Valenselektroner hver (i alt 14 for to kloratomer)
2. Arranger atomerne
* Carbon er det centrale atom, fordi det er det mindst elektronegative.
* Oxygen er dobbeltbundet til kulstof.
* De to kloratomer er enkeltbundet til kulstof.
3. Tegn obligationer og ensomme par
* Brug linjer til at repræsentere bindingerne mellem atomer.
* Udfyld de resterende valenselektroner som ensomme par omkring ilt- og kloratomer.
Her er prik- og krydsdiagrammet:
`` `
...
:O:
||
C
/ \
:Cl ::cl:
...
`` `
Forklaring:
* carbon: Har fire valenselektroner, som alle bruges til binding (to med ilt og en med hvert klor).
* ilt: Har seks valenselektroner. To bruges i dobbeltbindingen med kulstof, og de resterende fire er til stede som to ensomme par.
* klor: Hvert klor har syv valenselektroner. Den ene bruges i den enkelte binding med kulstof, og de resterende seks er til stede som tre ensomme par.
Nøglepunkter:
* Diagrammet viser de delte elektroner (bindinger) som linjer.
* Hver linje repræsenterer et delt par elektroner (et fra hvert bindingsatom).
* Enlige par vises som prikker.
* Diagrammet skal tilfredsstille Octet -reglen (undtagen brint, der følger duetreglen), hvilket betyder, at hvert atom (undtagen brint) skal have otte elektroner i dens valensskal.
Sidste artikelHvad er ligningen for kaliumbromid og vand?
Næste artikelHvad er densiteten af CO2 -gas ved STP?
 Varme artikler
Varme artikler
-
 Ny teknologi identificerer konsekvent proteiner fra et dusin cellerSammensmeltning af mikrofluidik og robotteknologi, forskere har udviklet en ny prøveudtagningsplatform, der giver aldrig-før-mulig indsigt i proteiner hos mennesker, dyr, og planteceller. Kredit:US De
Ny teknologi identificerer konsekvent proteiner fra et dusin cellerSammensmeltning af mikrofluidik og robotteknologi, forskere har udviklet en ny prøveudtagningsplatform, der giver aldrig-før-mulig indsigt i proteiner hos mennesker, dyr, og planteceller. Kredit:US De -
 Afblanding ved hjælp af lasere for at lave nye krystallerForskere har formået at adskille to væsker i en blanding ved hjælp af en laser, som de hævder vil føre til nye måder at manipulere stof på og skabe krystaller til industrien. I et papir offentliggjor
Afblanding ved hjælp af lasere for at lave nye krystallerForskere har formået at adskille to væsker i en blanding ved hjælp af en laser, som de hævder vil føre til nye måder at manipulere stof på og skabe krystaller til industrien. I et papir offentliggjor -
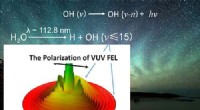 Undersøgelse afslører vandfotolyse og dets bidrag til hydroxyldagglødemissioner i atmosfæren på…Dalian kohærent lyskilde afslører vandfotolyse og dets bidrag til hydroxyldagglødemissioner i atmosfæren på Jorden og Mars. Kredit:CHANG Yao Jordens himmel viser en svag luminescens kendt som airg
Undersøgelse afslører vandfotolyse og dets bidrag til hydroxyldagglødemissioner i atmosfæren på…Dalian kohærent lyskilde afslører vandfotolyse og dets bidrag til hydroxyldagglødemissioner i atmosfæren på Jorden og Mars. Kredit:CHANG Yao Jordens himmel viser en svag luminescens kendt som airg -
 Fingeraftryks-narkotest virker på levende og afdødeKredit:CC0 Public Domain En revolutionerende lægemiddeltest udviklet fra forskning udført ved University of East Anglia kan påvise fire klasser af lægemidler i spor af sved fundet i et fingeraftry
Fingeraftryks-narkotest virker på levende og afdødeKredit:CC0 Public Domain En revolutionerende lægemiddeltest udviklet fra forskning udført ved University of East Anglia kan påvise fire klasser af lægemidler i spor af sved fundet i et fingeraftry
- Hvorfor er en krukke med småsten et rent stof?
- Hvordan chefer reagerer, har indflydelse på, om arbejderne siger deres mening
- Piranha livscyklus
- Boreværktøj bidrager til en betydelig reduktion af kulstofemissioner
- En ny flammehæmmende, røg-undertrykkende og superhydrofob gennemsigtig bambus til fremtidige brill…
- 7 Hvis et objekt ikke har nogen acceleration, kan du konkludere, at kræfter udøves på det?


