Hvordan kaldes overgangsmetaller i metalforbindelser?
1. Romertal:
* Variable afgifter: Overgangsmetaller har ofte flere mulige afgifter (oxidationstilstande). For at afklare, hvilken opladning der er til stede, bruger vi romertal I parentes efter metalnavnet.
* Eksempel:
* fecl2: Jern (II) Chlorid (Fe har en +2 ladning)
* fecl3: Jern (III) chlorid (Fe har en +3 ladning)
2. Undtagelser fra romerske tal:
* Faste gebyrer: Nogle overgangsmetaller * har altid den samme ladning i deres forbindelser. Disse kræver ikke romertal.
* Almindelige eksempler:
* AG: Sølv (altid +1)
* zn: Zink (altid +2)
* CD: Cadmium (altid +2)
3. Latinnavne:
* Historisk brug: For nogle metaller bruger vi deres latinnavne I det sammensatte navn, især for overgangsmetaller med almindelige afgifter.
* Eksempler:
* cucl: Kobber (I) Chlorid eller kobberklorid
* cucl2: Kobber (II) Chlorid eller Cupric Chlorid
* feo: Jern (II) Oxid eller jernholdigt oxid
* Fe2O3: Jern (III) oxid eller jernoxid
4. Navngivning af anioner:
* ikke-metaler: For ikke-metalanioner skal du bruge roden til navnet og tilføje "-ide."
* cl-: Chlorid
* o2-: Oxid
* s2-: Sulfid
* polyatomiske ioner: Disse har specifikke navne, du har brug for for at huske.
* no3-: Nitrat
* SO42-: Sulfat
* PO43-: Fosfat
Eksempel:
Lad os sige, at vi har forbindelsen cocl3 . Her er hvordan man navngiver det:
* CO: Cobalt (overgangsmetal med variabel opladning)
* Cl: Klor (ikke-metal, danner chlorid)
* Bestem gebyret for CO: Da chlorid har en -1 -ladning, og der er tre chlorider, er den samlede negative ladning -3. For at afbalancere dette skal kobolt have en +3 afgift.
* Endelig navn: Cobalt (III) chlorid
Husk: Øvelse gør perfekt. Med tilstrækkelig eksponering for navngivningsforbindelser begynder du at genkende almindelige mønstre og huske navnene!
Sidste artikelHvad hedder SNBR -forbindelsen?
Næste artikelHvordan adskiller vandige opløsninger af ioniske og molekylære forbindelser?
 Varme artikler
Varme artikler
-
 Samarbejde giver opdagelse af 12-sidede silicabureDoktorand Melik Turker, venstre, har en model af et dodekaeder i Ulrich Wiesners laboratorium. På billedet er også ph.d.-studerende Yunye Gong, centrum, holder en model af en burstruktur, og postdoc-f
Samarbejde giver opdagelse af 12-sidede silicabureDoktorand Melik Turker, venstre, har en model af et dodekaeder i Ulrich Wiesners laboratorium. På billedet er også ph.d.-studerende Yunye Gong, centrum, holder en model af en burstruktur, og postdoc-f -
 Forskere observerer skiftet af Ras-protein i detaljerDaniel Mann, Klaus Gerwert og Carsten Kötting (fra venstre) implementerer en proces til afkodning, der letter beregningen af eksperimentelle data såsom infrarøde spektre og nukleare spinspektre inds
Forskere observerer skiftet af Ras-protein i detaljerDaniel Mann, Klaus Gerwert og Carsten Kötting (fra venstre) implementerer en proces til afkodning, der letter beregningen af eksperimentelle data såsom infrarøde spektre og nukleare spinspektre inds -
 Fra superforseglinger til detektering af farlige kabler takket være ionstrålerSEM-billederne viser tværsnittene af NBR- og SBR-elastomerer udsat for He + ionstrålen med en flydende effekt på 1x10^17 cm-2. Bestråling med en højenergi-ionstråle forårsager tværbinding af polymerov
Fra superforseglinger til detektering af farlige kabler takket være ionstrålerSEM-billederne viser tværsnittene af NBR- og SBR-elastomerer udsat for He + ionstrålen med en flydende effekt på 1x10^17 cm-2. Bestråling med en højenergi-ionstråle forårsager tværbinding af polymerov -
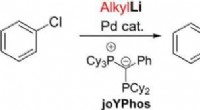 Direkte kobling af arylhalogenider og alkyllithiumforbindelser ved palladiumkatalyseKredit:Wiley Palladiumkatalysatorer hjælper med at syntetisere nøglekemikalier til mange industrier. Imidlertid, direkte reaktion af to grundlæggende reagenser, arylhalogenider og alkyllithiumforb
Direkte kobling af arylhalogenider og alkyllithiumforbindelser ved palladiumkatalyseKredit:Wiley Palladiumkatalysatorer hjælper med at syntetisere nøglekemikalier til mange industrier. Imidlertid, direkte reaktion af to grundlæggende reagenser, arylhalogenider og alkyllithiumforb
- Hvis empirisk formel er C2H5, hvilken molekylær formel?
- Hvordan afdækker planter deres indsats?
- Hvordan analiseres stjerner?
- Hvilket lag af sten dannet af sedimenter deponeret på land?
- Hvad er lagens atmosfære i faldende rækkefølge?
- Hvis en organisk forbindelse som glukose gennemgår hydrolyse, er reaktionen exergonisk. Sandt eller…


