Hvilket medlem af Thewe Pairs Substances ville du forvente at have et højere kogepunkt O2 eller N2 B SO2 CO2 C HF HI?
Forståelse af kogepunkt
Kogepunkt er den temperatur, hvormed en væske skifter til en gas. Jo stærkere de intermolekylære kræfter mellem molekyler, jo mere energi (og dermed højere temperatur) er påkrævet for at overvinde disse kræfter og få stoffet til at koge.
Intermolekylære kræfter
De primære intermolekylære kræfter, vi overvejer, er:
* London Dispersion Forces (LDF): Disse er til stede i alle molekyler og stammer fra midlertidige udsving i elektronfordeling. Større molekyler har stærkere LDF'er.
* dipol-dipol-kræfter: Disse forekommer mellem polære molekyler (molekyler med ujævn elektronfordeling).
* Hydrogenbinding: En speciel type dipol-dipolinteraktion, hvor brint er bundet til et meget elektronegativt atom (som O, N eller F). Dette er den stærkeste intermolekylære kraft.
analyse af parene
1. O2 eller N2:
* Både O2 og N2 er ikke -polære molekyler, så de har kun LDF'er.
* Oxygen (O2) har en større molekylvægt end nitrogen (N2). Større molekyler har stærkere LDF'er.
* Derfor har O2 et højere kogepunkt.
2. SO2 eller CO2:
* Både SO2 og CO2 er bøjede molekyler, hvilket gør dem polære.
* SO2 har et større dipolmoment (større polaritet) end CO2.
* Derfor har SO2 et højere kogepunkt.
3. hf eller hi:
* Både HF og HI er polære molekyler.
* HF udviser stærk hydrogenbinding, fordi brint er bundet til fluor (meget elektronegativ). Hej har ikke hydrogenbinding.
* Derfor har HF et meget højere kogepunkt.
Kortfattet:
* O2 har et højere kogepunkt end N2.
* SO2 har et højere kogepunkt end CO2.
* HF har et højere kogepunkt end HI.
Sidste artikelHvad er atomnummeret i O2?
Næste artikelHvad er farven på svovl opvarmet til ilt?
 Varme artikler
Varme artikler
-
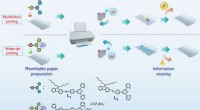 Specialpapir kan slettes og udskrives på flere gangeSkematisk illustration af flerfarve- og vandtryk. Kemiske strukturer af L 1 , L2 og L3, og udskrivnings- og sletteprocesserne for det konstruerede genskrivbare papir. Kredit: Naturkommunikation (2017
Specialpapir kan slettes og udskrives på flere gangeSkematisk illustration af flerfarve- og vandtryk. Kemiske strukturer af L 1 , L2 og L3, og udskrivnings- og sletteprocesserne for det konstruerede genskrivbare papir. Kredit: Naturkommunikation (2017 -
 Forskere designer transistorer baseret på ionisk gel lavet af en ledende polymerKredit:Pixabay/CC0 Public Domain Forskere ved University of Tsukuba har skabt en ny kulstofbaseret elektrisk enhed, π-ion gel transistorer (PIGTer) ved at bruge en ionisk gel lavet af en ledende p
Forskere designer transistorer baseret på ionisk gel lavet af en ledende polymerKredit:Pixabay/CC0 Public Domain Forskere ved University of Tsukuba har skabt en ny kulstofbaseret elektrisk enhed, π-ion gel transistorer (PIGTer) ved at bruge en ionisk gel lavet af en ledende p -
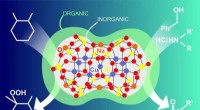 Kemikere syntetiserer en ny hybrid organisk-uorganisk katalysatorKredit:Natalia Deryugina RUDN -kemikere har syntetiseret metalkomplekser på basis af det organoelementale stof silsesquioxan, der består af en organisk og en uorganisk del. Sådanne hybridsystemer
Kemikere syntetiserer en ny hybrid organisk-uorganisk katalysatorKredit:Natalia Deryugina RUDN -kemikere har syntetiseret metalkomplekser på basis af det organoelementale stof silsesquioxan, der består af en organisk og en uorganisk del. Sådanne hybridsystemer -
 Nanopartikler i lithium-svovlbatterier opdaget med neutroneksperimentoperandocellen er udviklet hos HZB og gør det muligt at analysere processer inde i batteriet under opladningscyklusser med neutroner. Kredit:S. Risse/HZB Lithium-svovl-batterier betragtes som en a
Nanopartikler i lithium-svovlbatterier opdaget med neutroneksperimentoperandocellen er udviklet hos HZB og gør det muligt at analysere processer inde i batteriet under opladningscyklusser med neutroner. Kredit:S. Risse/HZB Lithium-svovl-batterier betragtes som en a
- Denne klynge af galakser består omkring 25 inklusive Mælkevejen?
- Undersøgelse af havodder viser, at brug af værktøj giver adgang til større bytte, reducerer tand…
- Nyder du udsigten? Hvordan computerspil kan hjælpe med at evaluere landskaber
- Hvor mange helium i luften?
- Hvad er en videnskabelig hypotese?
- Hvordan Stephen Hawking arbejdede


