Et problem med den kvantitative undersøgelse af magnesiumoxid er, at også reagerer, hvilke andre komponenter atmosfære?
Her er en sammenbrud:
* vand (H2O): MgO kan reagere med vand for at danne magnesiumhydroxid (Mg (OH) 2). Denne reaktion er især relevant, når MGO udsættes for fugtige miljøer.
* kuldioxid (CO2): MgO kan reagere med CO2 for at danne magnesiumcarbonat (MGCO3). Denne reaktion forekommer mere sandsynligt i nærvær af fugt, da vand fungerer som en katalysator.
Disse reaktioner kan komplicere kvantitative undersøgelser af MGO, fordi:
* de ændrer sammensætningen af prøven: Dannelsen af Mg (OH) 2 eller MGCO3 ændrer den kemiske sammensætning af den originale MGO, der påvirker målinger.
* De introducerer fejl i analyse: Hvis tilstedeværelsen af disse forbindelser ikke redegøres for, kan det føre til unøjagtige målinger af mængden af MGO, der er til stede.
for at minimere disse problemer, forskere ofte:
* Butik MGO i lufttætte containere: Dette hjælper med at minimere eksponeringen for fugt og CO2.
* Udfør eksperimenter i en kontrolleret atmosfære: Dette kan involvere anvendelse af en tør kasse eller inert gasrensning for at fjerne fugt og CO2.
* Konto for tilstedeværelsen af disse forbindelser i analyse: Dette kan involvere anvendelse af specifikke analytiske teknikker eller anvendelse af korrektionsfaktorer for at redegøre for tilstedeværelsen af Mg (OH) 2 og MGCO3.
Det er vigtigt at være opmærksom på disse potentielle reaktioner, når man udfører kvantitative undersøgelser af MGO for at sikre nøjagtige og pålidelige resultater.
 Varme artikler
Varme artikler
-
 At bryde fatbergs op - ingeniører udvikler teknik til at nedbryde fedtstoffer, olie og fedtEn UBC-metode til at nedbryde fedtstoffer, olie og fedt kan bruges i kommunale FOG-styringsprogrammer. Kredit:Clare Kiernan/UBC Madolie og lignende affald kan tilstoppe rør, skade fisk og endda vo
At bryde fatbergs op - ingeniører udvikler teknik til at nedbryde fedtstoffer, olie og fedtEn UBC-metode til at nedbryde fedtstoffer, olie og fedt kan bruges i kommunale FOG-styringsprogrammer. Kredit:Clare Kiernan/UBC Madolie og lignende affald kan tilstoppe rør, skade fisk og endda vo -
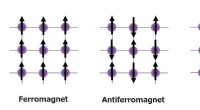 Forskere syntetiserer halvmetal uden magnetiseringSpinarrangement af magnetiske momenter i ferromagnetiske, antiferromagnetiske og ferrimagnetiske materialer. Kredit:Rie Umetsu En forskergruppe har med succes syntetiseret et halvmetal materiale og
Forskere syntetiserer halvmetal uden magnetiseringSpinarrangement af magnetiske momenter i ferromagnetiske, antiferromagnetiske og ferrimagnetiske materialer. Kredit:Rie Umetsu En forskergruppe har med succes syntetiseret et halvmetal materiale og -
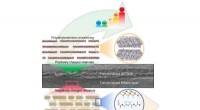 Bionisk idé øger ekstraktionen af lithium-ionMetalionsigtning ved hjælp af en bioinspireret nanokanalmembran (Billede af XIN Weiwen). Kredit:Chinese Academy of Sciences Litium er et energikritisk element, der er blevet en geopolitisk vigtig
Bionisk idé øger ekstraktionen af lithium-ionMetalionsigtning ved hjælp af en bioinspireret nanokanalmembran (Billede af XIN Weiwen). Kredit:Chinese Academy of Sciences Litium er et energikritisk element, der er blevet en geopolitisk vigtig -
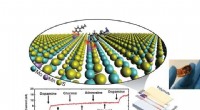 Meget følsom dopamindetektor bruger 2-D materialerSkematisk af en meget selektiv dopamindetektor ved brug af todimensionelt materiale. Kredit:Derrick Butler, Penn State En superfølsom dopamindetektor kan hjælpe med tidlig diagnosticering af flere
Meget følsom dopamindetektor bruger 2-D materialerSkematisk af en meget selektiv dopamindetektor ved brug af todimensionelt materiale. Kredit:Derrick Butler, Penn State En superfølsom dopamindetektor kan hjælpe med tidlig diagnosticering af flere
- Hvis du har 1,81 10 24 atomer kobber, hvordan kan mol have?
- Hvordan ser en ørkenstorm ud?
- Hvilke planeter er meget varme på den ene side og kolde den anden?
- Forskere laver fleksibelt glas til små medicinske apparater
- Hvem opdagede den største ø i Atlanterhavet?
- Om grundlæggende matematikfærdighedstest


