Hvad er det teoretiske udbytte, hvis 50 gram kobber får lov til at reagere med overskydende klor 101.6 gram dannet?
1. Afbalanceret kemisk ligning:
Den afbalancerede kemiske ligning for denne reaktion er:
Cu + Cl2 → Cucl2
2. Molære masser:
* Cu (kobber):63,55 g/mol
* Cl2 (klor):70,90 g/mol
* Cucl2 (kobberchlorid):134,45 g/mol
3. Mol kobber:
* Mol Cu =(Mass of Cu) / (Molær masse Cu)
* Mol Cu =(50 g) / (63,55 g / mol) =0,787 mol
4. Støkiometri:
Den afbalancerede ligning viser et forhold på 1:1 mol mellem kobber (Cu) og kobberchlorid (Cucl2). Dette betyder, at 0,787 mol kobber vil producere 0,787 mol kobberchlorid.
5. Teoretisk udbytte af Cucl2:
* Teoretisk udbytte af Cucl2 =(mol Cucl2) * (Molær masse Cucl2)
* Teoretisk udbytte af Cucl2 =(0,787 mol) * (134,45 g/mol) = 105,7 g
Derfor er det teoretiske udbytte af kobberchlorid (Cucl2) 105,7 gram
Bemærk: De givne oplysninger om, at 101,6 gram kobberchlorid blev dannet, er det faktiske udbytte, ikke det teoretiske udbytte. Det faktiske udbytte er normalt lavere end det teoretiske udbytte på grund af faktorer som ufuldstændige reaktioner eller tab under eksperimentet.
Sidste artikelHvad er den ioniske ladning for H?
Næste artikelHvad er molekyler, der består af kulstofhydrogen og ilt?
 Varme artikler
Varme artikler
-
 Supercomputing mere lys end varmeMaverick-supercomputersystemet ved Texas Advanced Computing Center. Maverick er en XSEDE-allokeret dedikeret visualiserings- og dataanalyseressource bygget med 132 NVIDIA Tesla K40 Atlas GPU til fjern
Supercomputing mere lys end varmeMaverick-supercomputersystemet ved Texas Advanced Computing Center. Maverick er en XSEDE-allokeret dedikeret visualiserings- og dataanalyseressource bygget med 132 NVIDIA Tesla K40 Atlas GPU til fjern -
 Kemikere, der overraskende opdagede nanokonfinerede reaktioner, kunne hjælpe med katalytisk designKredit:Georgia State University Georgia State University kemiforskere har afsløret et af mysterierne bag katalytiske reaktioner i mikroskopisk skala, giver mulighed for design af mere effektive in
Kemikere, der overraskende opdagede nanokonfinerede reaktioner, kunne hjælpe med katalytisk designKredit:Georgia State University Georgia State University kemiforskere har afsløret et af mysterierne bag katalytiske reaktioner i mikroskopisk skala, giver mulighed for design af mere effektive in -
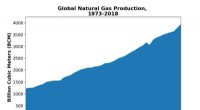 At lave mere af metanGlobal naturgasproduktion over år. Kredit:© 2020-data fra Det Internationale Energiagentur (IEA) Der er fortsat efterspørgsel efter plast og opløsningsmidler fremstillet af petrokemikalier, som ho
At lave mere af metanGlobal naturgasproduktion over år. Kredit:© 2020-data fra Det Internationale Energiagentur (IEA) Der er fortsat efterspørgsel efter plast og opløsningsmidler fremstillet af petrokemikalier, som ho -
 Analyse af fingermærker med synkrotronteknikker giver ny indsigtKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Resultaterne af ledende forskere Prof Simon Lewis og Dr. Mark Hackett kan give muligheder for at optimere nuværende fingermærk
Analyse af fingermærker med synkrotronteknikker giver ny indsigtKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Resultaterne af ledende forskere Prof Simon Lewis og Dr. Mark Hackett kan give muligheder for at optimere nuværende fingermærk
- Migrantbørn i Storbritannien forsvinder fra omsorgen – her er, hvordan du beskytter dem
- Radiobølger kan justere bakterier til at blive livreddende medicin
- Den globale økonomi vakler, da verden går i stå midt i en epidemi
- Big Data muliggør bedre bytransportnetværk
- Hvordan er Newtons tredje lov forbundet til universel gravitation?
- Hvordan lærer forskere om jordens lag?


