Hvor mange atomer er til stede i 4,0 mol?
* mol repræsenterer en mængde stof. En mol af ethvert stof indeholder det samme antal partikler (atomer, molekyler osv.), Som der er atomer i 12 gram carbon-12. Dette nummer kaldes Avogadros nummer, som er ca. 6,022 x 10^23.
* Forskellige stoffer har forskellige antal atomer pr. Molekyle. For eksempel:
* 1 mol helium (HE) indeholder 6,022 x 10^23 heliumatomer.
* 1 mol vand (H2O) indeholder 6,022 x 10^23 vandmolekyler, men det er 3 gange dette antal atomer (2 hydrogenatomer og 1 iltatom pr. Molekyle).
* 1 mol glukose (C6H12O6) indeholder 6,022 x 10^23 glukosemolekyler, men det er 24 gange dette antal atomer (6 carbon, 12 brint og 6 iltatomer pr. Molekyle).
For at beregne antallet af atomer i 4,0 mol af et stof skal du kende følgende:
1. stoffets kemiske formel.
2. Antallet af atomer pr. Molekyle (eller formelenhed) af stoffet.
Sådan gør du det:
1. Find antallet af atomer pr. Molekyle (eller formelenhed).
2. Multiplicer dette nummer med Avogadros nummer (6.022 x 10^23).
3. Multiplicer resultatet med antallet af mol (4,0 i dette tilfælde).
Eksempel:
Lad os sige, at du vil finde antallet af atomer i 4,0 mol vand (H2O).
1. der er 3 atomer pr. Vandmolekyle (2 brint og 1 ilt).
2. Antal atomer i 1 mol vand =3 atomer/molekyle * 6,022 x 10^23 molekyler/mol =1,807 x 10^24 atomer.
3. Antal atomer i 4,0 mol vand =1,807 x 10^24 atomer/mol * 4,0 mol =7,228 x 10^24 atomer.
Sidste artikelHvor mange atomer er der i kulstof?
Næste artikelHvad er den ioniske ladning for H?
 Varme artikler
Varme artikler
-
 Forskere løser et videnskabeligt mysterium om fordampningHadi Ghasemi, Cullen lektor i maskinteknik ved University of Houston, ledet forskning, der eliminerer flaskehalsen, der har komplicerede forudsigelser og simuleringer af processer, der involverer ford
Forskere løser et videnskabeligt mysterium om fordampningHadi Ghasemi, Cullen lektor i maskinteknik ved University of Houston, ledet forskning, der eliminerer flaskehalsen, der har komplicerede forudsigelser og simuleringer af processer, der involverer ford -
 Magnetiske bakterier som mikropumperKredit:Unsplash/CC0 Public Domain ETH-forskere bruger magnetiske bakterier til at kontrollere væsker på mikroniveau. De overvejer allerede at bruge dem i den menneskelige blodbane til præcis lever
Magnetiske bakterier som mikropumperKredit:Unsplash/CC0 Public Domain ETH-forskere bruger magnetiske bakterier til at kontrollere væsker på mikroniveau. De overvejer allerede at bruge dem i den menneskelige blodbane til præcis lever -
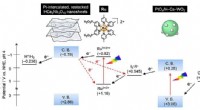 Ny fotokatalysator øger vandspaltningseffektiviteten til ren brintproduktionOxygenudviklingskatalysatoren reducerer effektivt koncentrationen af I3 - ioner og ændringer i hydrogenudviklingskatalysatoren forhindrer elektrontilbageførsel (stiplede røde linjer) og prioriterer
Ny fotokatalysator øger vandspaltningseffektiviteten til ren brintproduktionOxygenudviklingskatalysatoren reducerer effektivt koncentrationen af I3 - ioner og ændringer i hydrogenudviklingskatalysatoren forhindrer elektrontilbageførsel (stiplede røde linjer) og prioriterer -
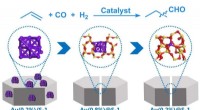 Forskere udvikler en ny Au-katalysator til hydroformyleringStrukturel modellering og ydelsessammenligning af Au-baserede katalysatorer. Kredit:SARI Som en af de største industrielle kemiske processer i dag, omdanner hydroformylering olefiner, H2 og CO ti
Forskere udvikler en ny Au-katalysator til hydroformyleringStrukturel modellering og ydelsessammenligning af Au-baserede katalysatorer. Kredit:SARI Som en af de største industrielle kemiske processer i dag, omdanner hydroformylering olefiner, H2 og CO ti
- Bliver Suns -energien stærkere længere, den bevæger sig?
- Hvad er det kemiske formel svovlmolekyle?
- EarthTalk:Hvad er nogle billige måder at gøre et hjem grønt på?
- Hvad er strøm, og hvad enheden til magt?
- Energi er omvendt proportional med bølgelængden af en bølge. Hvilken ville have største energi…
- Hvorfor er Jupiter Blue for?


