Den proces, hvormed nogle molekylære forbindelser opløses i vand for at danne ioner, er?
Her er en sammenbrud:
* molekylære forbindelser dannes ved deling af elektroner mellem atomer (kovalente bindinger).
* ioner er atomer eller grupper af atomer, der bærer en elektrisk ladning (enten positiv eller negativ).
* ionisering er processen, hvor et neutralt molekyle vinder eller mister elektroner, hvilket resulterer i dannelsen af ioner.
hvordan det fungerer i vand:
1. Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende og en lidt negativ ende på grund af den ujævne deling af elektroner.
2. attraktion: Når en polær molekylær forbindelse kommer ind i vandet, tiltrækker de positive og negative ender af vandmolekylerne de modsatte ladede ender af molekylet.
3. Bond Breaking: Den stærke tiltrækning mellem vandmolekylerne og den molekylære forbindelse kan overvinde bindingerne i molekylet, hvilket får det til at bryde fra hinanden.
4. iondannelse: De ødelagte fragmenter af molekylet forstærker eller mister elektroner, danner ioner.
Eksempel:
* Hydrogenchlorid (HCL) er en molekylær forbindelse. Når det opløses i vand, ioniserer det sig for at danne hydrogenioner (H+) og chloridioner (Cl-).
* HCL (G) + H2O (L) → H3O + (aq) + Cl- (aq)
Bemærk: Ikke alle molekylære forbindelser ioniserer i vand. Kun dem, der har polære bindinger og er i stand til at danne stærke interaktioner med vandmolekyler, vil gennemgå denne proces.
 Varme artikler
Varme artikler
-
 Vandbehandling:Fjernelse af hormoner med sollysIndsættelse af den fotokatalytiske membran i membranreaktoren. (Foto:Markus Breig, SÆT) Organiske forurenende stoffer såsom lægemidler, pesticider, og hormoner, selv ved koncentrationer på nanoska
Vandbehandling:Fjernelse af hormoner med sollysIndsættelse af den fotokatalytiske membran i membranreaktoren. (Foto:Markus Breig, SÆT) Organiske forurenende stoffer såsom lægemidler, pesticider, og hormoner, selv ved koncentrationer på nanoska -
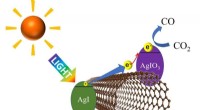 Brug af synligt lys til effektivt at nedbryde kuldioxidDen fotoeksciterede elektron fra sølviodid (AgI) bevæger sig langs kulnanorøret til sølviodat (AgIO 3 ) hvor kuldioxid (CO 2 ) reduceres til carbonmonoxid (CO). Kredit:Shinji Kawasaki og Yosuke Is
Brug af synligt lys til effektivt at nedbryde kuldioxidDen fotoeksciterede elektron fra sølviodid (AgI) bevæger sig langs kulnanorøret til sølviodat (AgIO 3 ) hvor kuldioxid (CO 2 ) reduceres til carbonmonoxid (CO). Kredit:Shinji Kawasaki og Yosuke Is -
 Fleksibel elektronisk hud hjælper mennesker-maskine interaktionerKredit:American Chemical Society Menneskets hud indeholder følsomme nerveceller, der registrerer tryk, temperatur og andre fornemmelser, der tillader taktile interaktioner med miljøet. For at hjæl
Fleksibel elektronisk hud hjælper mennesker-maskine interaktionerKredit:American Chemical Society Menneskets hud indeholder følsomme nerveceller, der registrerer tryk, temperatur og andre fornemmelser, der tillader taktile interaktioner med miljøet. For at hjæl -
 Computermodeller giver ny forståelse af seglcellesygdomEn ny modelleringsteknik gør det muligt for forskere at se, hvad der sker inde i røde blodlegemer, der er ramt af seglcellesygdom. Kredit:Karniadakis lab / Brown University Computermodeller udvikl
Computermodeller giver ny forståelse af seglcellesygdomEn ny modelleringsteknik gør det muligt for forskere at se, hvad der sker inde i røde blodlegemer, der er ramt af seglcellesygdom. Kredit:Karniadakis lab / Brown University Computermodeller udvikl
- Udfordring forudsiger, hvordan metaller med komplekse former og fremstilling vil bryde
- Hvilke to store nyheder tilladte for den første kolonisering af jordbaserede levesteder af planter?…
- Den voksende efterspørgsel efter dybere brønde udnytter gamle vandreserver
- Hvad har jordbaserede planeter og Jovian til fælles?
- Hvad kan vi lære af forsvindende dyrearter:Tilfældet med den pyrenæiske stenbukk
- Sådan fungerer lejer


