Computermodeller giver ny forståelse af seglcellesygdom
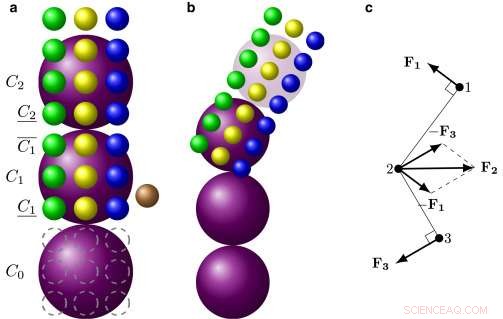
En ny modelleringsteknik gør det muligt for forskere at se, hvad der sker inde i røde blodlegemer, der er ramt af seglcellesygdom. Kredit:Karniadakis lab / Brown University
Computermodeller udviklet af Brown University-matematikere viser nye detaljer om, hvad der sker inde i et rødt blodlegeme, der er ramt af seglcellesygdom. Forskerne sagde, at de håber, at deres modeller, beskrevet i en artikel i Biofysisk tidsskrift , vil hjælpe med at vurdere lægemiddelstrategier til at bekæmpe den genetiske blodsygdom, som påvirker millioner af mennesker verden over.
Seglcellesygdom påvirker hæmoglobin, molekyler i røde blodlegemer, der er ansvarlige for at transportere ilt. I normale røde blodlegemer, hæmoglobin fordeles jævnt i hele cellen. I segl røde blodlegemer, muteret hæmoglobin kan polymerisere, når det mangler ilt, samler sig selv til lange polymerfibre, der skubber mod cellernes membraner, tvinger dem ud af form. Den stive, dårligt formede celler kan sætte sig fast i små kapillærer i hele kroppen, fører til smertefulde episoder kendt som seglcellekrise.
"Målet med vores arbejde er at modellere både hvordan disse seglhæmoglobinfibre dannes såvel som de mekaniske egenskaber af disse fibre, " sagde Lu Lu, en ph.d. studerende i Brown Division of Applied Mathematics og undersøgelsens hovedforfatter. "Der havde været separate modeller for hver af disse ting individuelt udviklet af os, men dette samler dem i én omfattende model."
Modellen bruger detaljerede biomekaniske data om, hvordan seglhæmoglobinmolekyler opfører sig og binder sig til hinanden for at simulere samlingen af en polymerfiber. Forud for dette arbejde, problemet havde været, at efterhånden som fiberen voksede, det samme gør mængden af data, modellen skal knække. Modellering af en hel polymerfiber i cellulær skala ved hjælp af detaljerne i hvert molekyle var simpelthen for beregningsmæssigt dyrt.
"Selv verdens hurtigste supercomputere ville ikke være i stand til at håndtere det, " sagde George Karniadakis, professor i anvendt matematik ved Brown og avisens seniorforfatter. "Der sker bare for meget, og der er ingen måde at fange det hele beregningsmæssigt på. Det var det, vi var i stand til at overkomme med dette arbejde."
Forskernes løsning var at anvende det, de kalder et mesoskopisk adaptivt opløsningsskema eller MARS. MARS-modellen beregner den detaljerede dynamik af hvert enkelt hæmoglobinmolekyle kun i hver ende af polymerfibre, hvor nye molekyler bliver rekrutteret ind i fiberen. Når fire lag af en fiber er blevet etableret, modellen ringer automatisk tilbage til den opløsning, hvormed den repræsenterer det pågældende afsnit. Modellen bevarer den vigtige information om, hvordan fiberen opfører sig mekanisk, men udviser de fine detaljer i hvert enkelt molekyle.
"Ved at eliminere de fine detaljer, hvor vi ikke har brug for dem, vi udvikler en model, der kan simulere hele denne proces og dens virkninger på et rødt blodlegeme, " sagde Karniadakis.
Ved at bruge de nye MARS-simuleringer, forskerne var i stand til at vise, hvordan forskellige konfigurationer af voksende polymerfibre er i stand til at producere celler med forskellige former. Selvom sygdommen har fået sit navn, fordi den får mange røde blodlegemer til at antage en segl-lignende form, der er faktisk en række unormale celleformer til stede. Denne nye modelleringstilgang viste nye detaljer om, hvordan forskellige fiberstrukturer inde i cellen producerer forskellige celleformer.
"Vi er i stand til at producere en polymerisationsprofil for hver af de celletyper, der er forbundet med sygdommen, "Karniadakis sagde. "Nu er målet at bruge disse modeller til at lede efter måder at forhindre sygdomsudbrud på."
Der er kun ét lægemiddel på markedet, der er godkendt af FDA til behandling af seglcelle, siger Karniadakis. Det stof, kaldet hydroxyurinstof, menes at virke ved at øge mængden af føtalt hæmoglobin - den slags hæmoglobin, som babyer bliver født med - i en patients blod. Fosterhæmoglobin er resistent over for polymerisering og, når det er til stede i tilstrækkelig mængde, menes at forstyrre polymerisationen af seglcellehæmoglobin.
Ved at bruge disse nye modeller, Karniadakis og hans kolleger kan nu køre simuleringer, der inkluderer føtalt hæmoglobin. Disse simuleringer kunne være med til at bekræfte, at føtalt hæmoglobin faktisk forstyrrer polymeriseringen, samt hjælp til at fastslå, hvor meget føtalt hæmoglobin, der er nødvendigt. Det kunne hjælpe med at etablere bedre doseringsvejledninger eller til at udvikle nye og mere effektive lægemidler, siger forskerne.
"Modellerne giver os en måde at udføre foreløbige test af nye tilgange til at stoppe denne sygdom, " sagde Karniadakis. "Nu hvor vi kan simulere hele polymerisationsprocessen, vi tror, modellerne vil være meget mere nyttige."
 Varme artikler
Varme artikler
-
 Samling af komplekse molekylerNukleosider er grundlæggende byggesten i genetisk materiale, hvilket gør dem attraktive til en række biologisk relevante anvendelser og som potentielle lægemidler. På City College i New York, forskere
Samling af komplekse molekylerNukleosider er grundlæggende byggesten i genetisk materiale, hvilket gør dem attraktive til en række biologisk relevante anvendelser og som potentielle lægemidler. På City College i New York, forskere -
 Forskere opdager et nyt uorganisk materiale med den laveste varmeledningsevne, der nogensinde er rap…Brug den rigtige kemi, det er muligt at kombinere to forskellige atomarrangementer (gule og blå plader), der giver mekanismer til at bremse varmebevægelsen gennem et fast stof. Denne strategi giver de
Forskere opdager et nyt uorganisk materiale med den laveste varmeledningsevne, der nogensinde er rap…Brug den rigtige kemi, det er muligt at kombinere to forskellige atomarrangementer (gule og blå plader), der giver mekanismer til at bremse varmebevægelsen gennem et fast stof. Denne strategi giver de -
 ORNL opfylder FDA's vigtigste milepæl for kræftbekæmpende Ac-225 isotopMålrettet alfaterapi kan levere stråling til specifikke celler, med minimal indvirkning på omgivelserne, sunde celler. Kredit:Michelle Lehman og Jaimee Janiga/ORNL, US Department of Energy En sjæl
ORNL opfylder FDA's vigtigste milepæl for kræftbekæmpende Ac-225 isotopMålrettet alfaterapi kan levere stråling til specifikke celler, med minimal indvirkning på omgivelserne, sunde celler. Kredit:Michelle Lehman og Jaimee Janiga/ORNL, US Department of Energy En sjæl -
 Forskere undersøger makrocykliske peptider som nye lægemiddelskabelonerNogle af disse molekyler kan krydse cellemembranen og kan åbne døre for nye lægemidler til i øjeblikket ubehandlede sygdomme. Kredit:Gwangju Institute of Science and Technology Takket være vores f
Forskere undersøger makrocykliske peptider som nye lægemiddelskabelonerNogle af disse molekyler kan krydse cellemembranen og kan åbne døre for nye lægemidler til i øjeblikket ubehandlede sygdomme. Kredit:Gwangju Institute of Science and Technology Takket være vores f


