Hvorfor fremstiller protoner og elektroner iltnitrogenmolekyler glød?
* excitation: Når ilt- eller nitrogenmolekyler udsættes for en energikilde, som varme eller elektricitet, absorberer deres elektroner energien og hopper til højere energiniveau. Dette kaldes excitation.
* Emission: De ophidsede elektroner er ustabile og vil vende tilbage til deres jordtilstand. Når de gør det, frigiver de den absorberede energi i form af lys.
* Farve: Den specifikke farve, der udsendes, afhænger af den frigivne mængde energi, som bestemmes af de specifikke energiniveau, der er involveret i overgangen.
Eksempler:
* Lyn: Højspændingen i lyn begejstrer nitrogen- og iltmolekyler i luften, hvilket får dem til at udsende lys og skabe den karakteristiske lyn.
* aurora borealis: Ladede partikler fra solen interagerer med jordens magnetfelt og ophidser atmosfæriske gasser, hvilket skaber de livlige skærme fra Aurora.
* neonskilte: Elektricitet begejstrer gassen inde i røret, hvilket får den til at udsende en bestemt lysfarve.
Vigtig note: Det er ikke kun protoner og elektroner, men hele molekylets opførsel, der bidrager til glødet.
Sidste artikelKemisk symbol for den mest stabile ion af barium?
Næste artikelHvad er de almindelige oxidformler fra Fermium?
 Varme artikler
Varme artikler
-
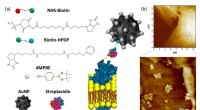 En biosensor til måling af ekstracellulære hydrogenperoxidkoncentrationerFigur 1:(a) Forklarende skitse af plasmamembranen forankret nanosensor. De forbindelser, der bruges til guldnanopartikler (AuNP) -konjugering, er den H2O2-følsomme 4-mercaptophenylboroniske pinacolest
En biosensor til måling af ekstracellulære hydrogenperoxidkoncentrationerFigur 1:(a) Forklarende skitse af plasmamembranen forankret nanosensor. De forbindelser, der bruges til guldnanopartikler (AuNP) -konjugering, er den H2O2-følsomme 4-mercaptophenylboroniske pinacolest -
 Nedbrydelig ligninbaseret polyurethanadsorbent til effektiv oprensning af råolieGrafisk abstrakt. Kredit: Chemical Engineering Journal (2021). DOI:10.1016/j.cej.2021.128956 En forskergruppe ledet af prof. Zhu Jin ved Ningbo Institute of Materials Technology and Engineering (
Nedbrydelig ligninbaseret polyurethanadsorbent til effektiv oprensning af råolieGrafisk abstrakt. Kredit: Chemical Engineering Journal (2021). DOI:10.1016/j.cej.2021.128956 En forskergruppe ledet af prof. Zhu Jin ved Ningbo Institute of Materials Technology and Engineering ( -
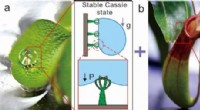 En ny salvinia-lignende glat overfladeDesign af den Salvinia-lignende glatte overflade. (a) Salvinia molesta flydende blad, hvor vanddråbe viser stabil Cassie-tilstand. Selvom det rationelle design af elastisk æggepiskerformet mikrostrukt
En ny salvinia-lignende glat overfladeDesign af den Salvinia-lignende glatte overflade. (a) Salvinia molesta flydende blad, hvor vanddråbe viser stabil Cassie-tilstand. Selvom det rationelle design af elastisk æggepiskerformet mikrostrukt -
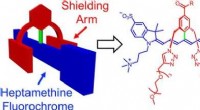 Stabile og funktionelle farvestoffer til nær-infrarød fluorescensbilleddannelse af levende individ…Kredit:Wiley Forskere kan overvåge biomolekylære processer i levende væv ved hjælp af ikke-invasive optiske metoder, såsom fluorescensbilleddannelse. Imidlertid, de fluorescerende farvestoffer, de
Stabile og funktionelle farvestoffer til nær-infrarød fluorescensbilleddannelse af levende individ…Kredit:Wiley Forskere kan overvåge biomolekylære processer i levende væv ved hjælp af ikke-invasive optiske metoder, såsom fluorescensbilleddannelse. Imidlertid, de fluorescerende farvestoffer, de
- Et grafensystem, der fryser elektroner, når temperaturen stiger
- Blåt fosfor:Hvordan en halvleder bliver til metal
- Fotoforfalskning fanget via overlisteteknikker
- Hvad er det ioniske sammensatte navn på MGI2?
- Industrielle kemikalier går fra mor til foster under hele graviditeten
- Kina-hedebølge presser priserne op, da høns lægger færre æg


