Vil kaliumchlorid være mere opløseligt i vand eller isopropanol?
* Polaritet: Vand (H₂O) er et meget polært opløsningsmiddel på grund af elektronegativitetsforskellen mellem ilt og brintatomer, hvilket skaber en delvis negativ ladning på ilt og delvis positive ladninger på brint. Isopropanol (c₃h₈o) er også polær, men mindre end vand.
* ioniske forbindelser: Kaliumchlorid er en ionisk forbindelse, hvilket betyder, at det er sammensat af positivt ladede kaliumioner (K⁺) og negativt ladede chloridioner (CL⁻).
* "som opløser som": Polære opløsningsmidler som vand er gode til at opløse ioniske forbindelser. De polære vandmolekyler kan omringe og adskille ionerne på grund af elektrostatiske interaktioner. Isopropanol, mens den er polær, er ikke så god til at bryde de stærke ioniske bindinger i KCl.
Kortfattet: Vands høje polaritet og evne til at danne stærke elektrostatiske interaktioner med ioner gør det til et bedre opløsningsmiddel for kaliumchlorid end isopropanol.
Sidste artikelHvilken slags binding er lithiumchlorid?
Næste artikelHvad bruges mineral zircon til?
 Varme artikler
Varme artikler
-
 Løsningen på et forvirrende fænomen kan åbne døren til forbedret koldsprøjteeffektivitetDen øverste del viser en koldspray kobber belægning, med meget synlige hvirvellignende strukturer, der snurrer rundt om et aluminiumsunderlag i bunddelen. Kredit:EBSD Et internationalt forskerteam
Løsningen på et forvirrende fænomen kan åbne døren til forbedret koldsprøjteeffektivitetDen øverste del viser en koldspray kobber belægning, med meget synlige hvirvellignende strukturer, der snurrer rundt om et aluminiumsunderlag i bunddelen. Kredit:EBSD Et internationalt forskerteam -
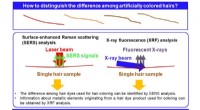 Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc
Inden for en hårsbredde – retsmedicinsk identifikation af enkeltfarvet hårstrå nu muligtEn oversigt over de analytiske teknikker, der er brugt i denne undersøgelse, som tilsammen gør det muligt at skelne mellem to enkeltstrå farvet hår. Kredit:Shinsuke Kunimura fra Tokyo University of Sc -
 Insektantibiotikum giver en ny måde at fjerne bakterier påRygget soldaterfejl. Kredit:USDA/Wikmedia Commons Et antibiotikum kaldet thanatin angriber den måde, hvorpå den ydre membran af gramnegative bakterier er opbygget. Forskere ved universitetet i Zür
Insektantibiotikum giver en ny måde at fjerne bakterier påRygget soldaterfejl. Kredit:USDA/Wikmedia Commons Et antibiotikum kaldet thanatin angriber den måde, hvorpå den ydre membran af gramnegative bakterier er opbygget. Forskere ved universitetet i Zür -
 Høje reaktionshastigheder selv uden ædle metallerI denne afskærmede celle, Abdelilah El Arrassi tester nanopartiklerne i elektrokemiske eksperimenter. Kredit:RUB, Kramer Nanopartikler af ikke-ædelmetal kan en dag erstatte dyre katalysatorer til
Høje reaktionshastigheder selv uden ædle metallerI denne afskærmede celle, Abdelilah El Arrassi tester nanopartiklerne i elektrokemiske eksperimenter. Kredit:RUB, Kramer Nanopartikler af ikke-ædelmetal kan en dag erstatte dyre katalysatorer til
- Hvad kan der ses af jorden, fordi de reflekterer lys et objekt?
- ATLAS -eksperiment søger efter naturlig supersymmetri ved hjælp af nye teknikker
- Hvordan adskiller den stærke kraft sig fra tyngdekraften og elektromagnetisme?
- Matematik kurser i College
- Airbus og Dassault går sammen om kampfly
- Hvorfor rejser lydbølger hurtigere i tættere stoffer?


