Hvordan påvirker tilstedeværelsen af et opløst stof fryse- og kogepunkter opløsningsmiddel?
Frysningspunktdepression:
* Forklaring: Tilsætningen af et opløst stof forstyrrer det ordnede arrangement af opløsningsmiddelmolekyler, der forekommer under frysning. Solute -partiklerne kommer i vejen, hvilket gør det vanskeligere for opløsningsmiddelmolekylerne at danne et fast gitter.
* Effekt: Opløsningens frysepunkt er lavere end det frysepunkt for det rene opløsningsmiddel.
* Eksempel: Tilsætning af salt til vand sænker sit frysepunkt, og det er grunden til, at salt bruges til at smelte is på veje om vinteren.
Kogepunkthøjde:
* Forklaring: Opløsningspartiklerne forstyrrer opløsningsmidlets damptryk. Solute -molekylerne forstyrrer flugt af opløsningsmiddelmolekyler i dampfasen, hvilket kræver en højere temperatur for at opnå det samme damptryk som det rene opløsningsmiddel.
* Effekt: Løsningens kogepunkt er højere end kogepunktet for det rene opløsningsmiddel.
* Eksempel: Tilsætning af sukker til vand hæver sit kogepunkt, hvorfor det tager længere tid at koge sukkerholdigt vand end almindeligt vand.
Nøglepunkter:
* Ikke-flygtige opløste stoffer: Opløsningen skal være ikke-flygtig (ikke let fordampet) for at disse effekter skal være betydningsfulde.
* Molaritet og koncentration: Omfanget af frysepunktdepression og kogepunkthøjde afhænger af koncentrationen af opløstelsen i opløsningen. Højere opløsningsmiddelkoncentrationer fører til større ændringer i frysnings- og kogepunkter.
* Natur af opløst stof: Mens identiteten af opløstelsen ikke påvirker størrelsen Af ændringen kan det påvirke tegn (positiv eller negativ) i nogle specielle tilfælde (f.eks. Elektrolytter). Elektrolytter, som salte, adskiller sig i ioner i opløsning, hvilket effektivt øger antallet af opløste partikler og forbedrer således effekten.
Formler:
Ændringerne i fryse- og kogepunkter kan beregnes ved hjælp af følgende formler:
* frysningspunktdepression: ΔT f =K f * m
* kogepunkthøjde: ΔT b =K b * m
Hvor:
* ΔT f og ΔT b er ændringerne i henholdsvis frysnings- og kogepunkter.
* K f og k b er frysepunkt depression og kogepunkthøjde konstanter for opløsningsmidlet.
* M er molaliteten af opløsningen (mol opløst stof pr. Kg opløsningsmiddel).
Disse formler hjælper med at kvantificere effekten af opløst tilstedeværelse på frysnings- og kogepunkter for opløsningsmidler, hvilket muliggør forudsigelser og beregninger i forskellige anvendelser.
 Varme artikler
Varme artikler
-
 Kvantekemi løser mysteriet med de 20 aminosyrer i den genetiske kodeDe første 13 aminosyrer er karakteriseret ved meget ens kemisk hårdhed og elektroniske energiniveauer (vist på billedet som en enkelt cirkel). De nye aminosyrer blev mere og mere blødere og mere indiv
Kvantekemi løser mysteriet med de 20 aminosyrer i den genetiske kodeDe første 13 aminosyrer er karakteriseret ved meget ens kemisk hårdhed og elektroniske energiniveauer (vist på billedet som en enkelt cirkel). De nye aminosyrer blev mere og mere blødere og mere indiv -
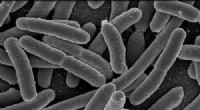 Ingeniører udtænker en ny metode til at fjerne skadelige E. coli fra vandEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Ingeniører ved Monash University har fundet frem til en forbedret metode til at fjerne potentielt dødelige bakterier, såsom E. coli
Ingeniører udtænker en ny metode til at fjerne skadelige E. coli fra vandEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Ingeniører ved Monash University har fundet frem til en forbedret metode til at fjerne potentielt dødelige bakterier, såsom E. coli -
 Elektronisk affald udvindes for sjældne jordarterOak Ridge National Laboratory’s Ramesh Bhave co-opfandt en proces til genopretning af sjældne jordartselementer med høj renhed fra skrotede magneter af computerharddiske (vist her) og andet affald fra
Elektronisk affald udvindes for sjældne jordarterOak Ridge National Laboratory’s Ramesh Bhave co-opfandt en proces til genopretning af sjældne jordartselementer med høj renhed fra skrotede magneter af computerharddiske (vist her) og andet affald fra -
 Ny bæredygtig produktionsmetode kan fremme plast og lægemidlerIngeniører fra University of Texas viser deres skoleånd frem ved at støbe den nye, bæredygtigt produceret plastmateriale til en Longhorn-silhuet i Hal Alpers laboratorium. Kredit:Cockrell School of En
Ny bæredygtig produktionsmetode kan fremme plast og lægemidlerIngeniører fra University of Texas viser deres skoleånd frem ved at støbe den nye, bæredygtigt produceret plastmateriale til en Longhorn-silhuet i Hal Alpers laboratorium. Kredit:Cockrell School of En
- Føler du dig varm og generet? Det er kompliceret
- En batterifri sensor til undervandsudforskning
- Hvis det er vanskeligt for elektricitet at flyde gennem en komponent, har det højt?
- Hvor slem er strålingen på Mars?
- Hvorfor er hastigheden af accelereret krop muligvis nul?
- Hvad er 150 grader celsius lig med i Fahrenheit?


