Hvad fungerer pyridin, som når det reagerer med vand til dannelse af hydroxid?
Her er en sammenbrud af hvorfor:
* Pyridins grundlæggende: Pyridin er en svag base, hvilket betyder, at den har en relativt lav tendens til at acceptere protoner (H+). Det er en heterocyklisk aromatisk forbindelse med et nitrogenatom i ringen. Dette nitrogenatom har et ensomt par elektroner, der kan fungere som en base, men det er ikke så let tilgængeligt som de ensomme par i en simpel amin.
* vands surhed: Vand er en meget svag syre. Selvom det kan fungere som både en syre og en base, er det ikke stærkt nok til at donere en proton til pyridin.
Hvad sker der faktisk:
Når pyridin opløses i vand, kan det gennemgå en hydrolyse -reaktion . Dette involverer nitrogenatom i pyridin, der accepterer en proton fra et vandmolekyle. Dette danner pyridiniumion (C5H5NH+) og A hydroxidion (OH-) Imidlertid er denne reaktion i ligevægt og favoriserer reaktanterne.
Kortfattet:
Pyridin reagerer ikke direkte med vand for at producere hydroxid. Det fungerer som en svag base ved at acceptere en proton fra vand til dannelse af pyridiniumion og hydroxidion, men denne reaktion er begrænset og favoriserer udgangsmaterialet.
 Varme artikler
Varme artikler
-
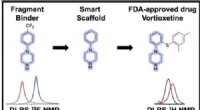 Låse dørene op til effektive COVID-19-behandlingerKredit:Majid D. Farahani et al., DOI:10.1002/cmdc.202200092 Et hold af tværfaglige forskere fra Institut National de la Recherche Scientifique (INRS) håber at kunne identificere effektive COVID-19-
Låse dørene op til effektive COVID-19-behandlingerKredit:Majid D. Farahani et al., DOI:10.1002/cmdc.202200092 Et hold af tværfaglige forskere fra Institut National de la Recherche Scientifique (INRS) håber at kunne identificere effektive COVID-19- -
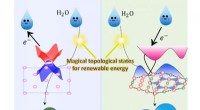 Fremskynde brintproduktionen ved hjælp af de magiske topologiske overfladetilstandeTopologiske ikke-trivielle overfladetilstande kan acceptere eller donere elektroner under vandelektrolyseprocessen. Kredit:MPI CPfS Brintøkonomien anses for at være en af de bedste muligheder fo
Fremskynde brintproduktionen ved hjælp af de magiske topologiske overfladetilstandeTopologiske ikke-trivielle overfladetilstande kan acceptere eller donere elektroner under vandelektrolyseprocessen. Kredit:MPI CPfS Brintøkonomien anses for at være en af de bedste muligheder fo -
 Molekyler omdanner synligt lys til ultraviolet lys med rekordeffektivitetEt nyudviklet molekylært system i glasrøret til højre opkonverterer effektivt synligt lys selv fra typiske LEDer til ultraviolet lys gennem triplet-triplet udslettelse. Udviklet af forskere ved Kyushu
Molekyler omdanner synligt lys til ultraviolet lys med rekordeffektivitetEt nyudviklet molekylært system i glasrøret til højre opkonverterer effektivt synligt lys selv fra typiske LEDer til ultraviolet lys gennem triplet-triplet udslettelse. Udviklet af forskere ved Kyushu -
 Indeholder en atomulykke med grundmineralerSandia National Laboratories forskergruppemedlemmer Jessica Kruichak og William Chavez testede granuleret calcit og sand mod blyoxid. Det granulære calcit og blyoxid havde en hævnings- og afkølingsrea
Indeholder en atomulykke med grundmineralerSandia National Laboratories forskergruppemedlemmer Jessica Kruichak og William Chavez testede granuleret calcit og sand mod blyoxid. Det granulære calcit og blyoxid havde en hævnings- og afkølingsrea
- Hvad er den kemiske sammensætning af grønt pulver på rådne citroner?
- Franske lovgivere forbyder smartphones i skolerne
- Californiens brandskader på hjem er mindre tilfældige, end det ser ud til
- Hvilken side af ligningerne findes reaktanter?
- En bestemmelse af masserne og antal mol svovl -ilt i sammensat dioxid?
- Sådan beregnes indlæsning Rates


