En vandig opløsning af natriumchlorid klassificeres bedst som en?
* elektrolytter er stoffer, der udfører elektricitet, når de opløses i vand. Dette skyldes, at de adskiller sig i ioner, som er ladede partikler, der kan bære en elektrisk strøm.
* natriumchlorid (NaCl) Opløser i vand til dannelse af natriumioner (Na+) og chloridioner (Cl-). Disse ioner er frie til at bevæge sig rundt i opløsningen, hvilket giver løsningen mulighed for at udføre elektricitet.
Lad os sammenligne det med andre muligheder:
* nonelectrolyte: Et stof, der ikke udfører elektricitet, når det er opløst i vand. Eksempler inkluderer sukker og alkohol.
* syre: Et stof, der producerer hydrogenioner (H+), når de opløses i vand.
* base: Et stof, der producerer hydroxidioner (OH-), når det opløses i vand.
Mens natriumchlorid har nogle basale egenskaber på grund af hydroxidionerne, det danner i opløsning, klassificeres det primært som en elektrolyt på grund af dens evne til at udføre elektricitet.
Sidste artikelHvilke to egenskaber ved saccharose adskiller det fra natriumchlorid?
Næste artikelEr H20 væske-H2O fast endotermisk?
 Varme artikler
Varme artikler
-
 Molekylær magnetisme pakker strøm med messenger -elektronAtomer på tilstødende molekyler som dette kan kobles til en lang, magnetisk kæde, skabe en ny type magnetisk struktur, siger John Berry, professor i kemi ved University of Wisconsin-Madison. Kredit:Da
Molekylær magnetisme pakker strøm med messenger -elektronAtomer på tilstødende molekyler som dette kan kobles til en lang, magnetisk kæde, skabe en ny type magnetisk struktur, siger John Berry, professor i kemi ved University of Wisconsin-Madison. Kredit:Da -
 Kaliumdrevne genopladelige batterier:En indsats mod et mere bæredygtigt miljøKalium-drevne genopladelige batteriers funktioner for et mere bæredygtigt samfund i fremtiden. Kredit:Tokyo University of Science Vores moderne livsstil ville være uhyre anderledes uden genopladel
Kaliumdrevne genopladelige batterier:En indsats mod et mere bæredygtigt miljøKalium-drevne genopladelige batteriers funktioner for et mere bæredygtigt samfund i fremtiden. Kredit:Tokyo University of Science Vores moderne livsstil ville være uhyre anderledes uden genopladel -
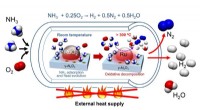 Opdagelse af en let proces til H2 -produktion ved hjælp af ammoniak som bærerH2 -produktion fra ammoniak og ilt udløses ved stuetemperatur uden ekstern varmeindgang. Kredit:Oita University Hydrogen (H2) har tiltrukket sig betydelig opmærksomhed som en ren energikilde, ford
Opdagelse af en let proces til H2 -produktion ved hjælp af ammoniak som bærerH2 -produktion fra ammoniak og ilt udløses ved stuetemperatur uden ekstern varmeindgang. Kredit:Oita University Hydrogen (H2) har tiltrukket sig betydelig opmærksomhed som en ren energikilde, ford -
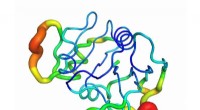 Gotcha! Forskere fingeraftryksproteiner ved hjælp af deres vibrationerEn illustration visualiserer dihydrofolatreduktase, et af de proteiner forskere undersøgte. Farverne angiver intensiteten af proteinets bevægelse forskellige steder, lige fra blå (mindre bevægelse)
Gotcha! Forskere fingeraftryksproteiner ved hjælp af deres vibrationerEn illustration visualiserer dihydrofolatreduktase, et af de proteiner forskere undersøgte. Farverne angiver intensiteten af proteinets bevægelse forskellige steder, lige fra blå (mindre bevægelse)
- Hvad er en regnskov så vigtig?
- Fysikere gør det muligt at 3D-udskrive dit eget babyunivers
- Undersøgelse udforsker, hvordan sten udvider sig nær jordoverfladen i det sydlige Sierra Nevada
- Kemisk tilpasset grafen
- På vej mod bedre prognoser for fliseskred
- Antag, at du har en sukkeropløsning, og lad den fordampe at efterlade krystaller. Er disse minerale…


