Hvorfor er plus 2 en almindelig oxidationstilstand for overgangselementer?
1. Elektronisk konfiguration:
* Overgangsmetaller har en delvist fyldt D-orbital.
* At miste to elektroner fra den yderste S-Orbital (NS²) resulterer i en stabil D¹⁰-konfiguration, der ligner den ædle gaskonfiguration.
* Denne stabile konfiguration bidrager til stabiliteten af +2 oxidationstilstand.
2. Ioniseringsenergi:
* Overgangsmetaller har generelt relativt lave anden ioniseringsenergier. Dette betyder, at fjernelse af det andet elektron fra metalatomet er energisk gunstigt, hvilket bidrager til dannelsen af +2 ioner.
3. Dannelse af ioniske forbindelser:
* +2 oxidationstilstand tillader overgangsmetaller at danne ioniske forbindelser med en lang række ikke-metaler, såsom ilt, halogener og svovl.
* Disse forbindelser er ofte stabile og let dannet.
Eksempler:
* jern (Fe): Fe²⁺ er en almindelig oxidationstilstand, der findes i forbindelser som jernoxid (FEO).
* kobber (CU): Cu²⁺ findes i forbindelser som kobbersulfat (cuso₄).
* cobalt (CO): CO²⁺ findes i forbindelser som koboltchlorid (Cocl₂).
Undtagelser:
* Nogle overgangsmetaller har også andre almindelige oxidationstilstande, såsom +3, +4 og +7.
* For eksempel har mangan (Mn) en almindelig oxidationstilstand på +7 i permanganation (Mno₄⁻).
Konklusion:
+2 oxidationstilstand er et almindeligt træk for mange overgangsmetaller på grund af den elektroniske konfiguration, ioniseringsenergi og dannelse af ioniske forbindelser. Denne almindelige oxidationstilstand resulterer i den store mangfoldighed af overgangsmetalkemi.
 Varme artikler
Varme artikler
-
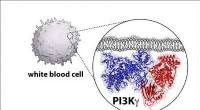 Kemikere udvikler en ny plan for enzym involveret i kræftKredit:University of Oregon Forskere har i årtier vidst, at en bestemt klasse af enzymer er en vigtig aktør inden for cellebiologi, fordi de ofte muterer og bliver væsentlige årsager til kræft. B
Kemikere udvikler en ny plan for enzym involveret i kræftKredit:University of Oregon Forskere har i årtier vidst, at en bestemt klasse af enzymer er en vigtig aktør inden for cellebiologi, fordi de ofte muterer og bliver væsentlige årsager til kræft. B -
 3D-udskrivning gør nanomaskiner til arbejdere i stor størrelseEn 3D-trykt gelstruktur løfter og sænker en krone i USA, når den skiftevis udsættes for vand og DMSO-opløsningsmiddel. Kredit:© Chenfeng Ke Ved hjælp af avanceret 3D-udskrivning, Dartmouth College
3D-udskrivning gør nanomaskiner til arbejdere i stor størrelseEn 3D-trykt gelstruktur løfter og sænker en krone i USA, når den skiftevis udsættes for vand og DMSO-opløsningsmiddel. Kredit:© Chenfeng Ke Ved hjælp af avanceret 3D-udskrivning, Dartmouth College -
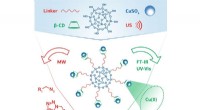 Kemiker skaber nye katalysatorer til klikreaktionerKredit:RUDN University En kemiker fra RUDN University har skabt en række katalysatorer til klikkemi. Disse reaktioner er meget udbredt i syntesen af biologisk aktive stoffer, såvel som i biologi
Kemiker skaber nye katalysatorer til klikreaktionerKredit:RUDN University En kemiker fra RUDN University har skabt en række katalysatorer til klikkemi. Disse reaktioner er meget udbredt i syntesen af biologisk aktive stoffer, såvel som i biologi -
 Guldnanopartikler øger lysemissionen fra wolframdisulfidFiguren viser fluorescensmikroskopibilledet af en trekantet WS2-flage. Indsatsen viser det optiske mikroskopibillede af monoflaken. (a) Når ophidset, den trekantede flage gløder og viser et fængslende
Guldnanopartikler øger lysemissionen fra wolframdisulfidFiguren viser fluorescensmikroskopibilledet af en trekantet WS2-flage. Indsatsen viser det optiske mikroskopibillede af monoflaken. (a) Når ophidset, den trekantede flage gløder og viser et fængslende
- Hvad er engery i bevægelse?
- Hvordan læser du teori -svar?
- Hvis jorden modtog mere energi, end den transmitterede over en lang periode, ville begynde at køle …
- Kosmisk katastrofe tillader præcis test af generel relativitet
- Hvad gør ægløsning for en plante?
- Hvad er det vigtigste brændstof, der bruges i termiske kraftværker?


