Kemikere udvikler en ny plan for enzym involveret i kræft
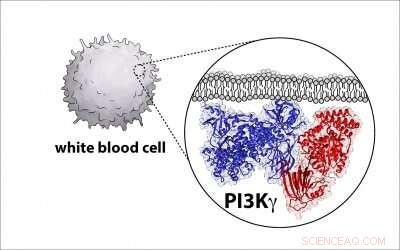
Kredit:University of Oregon
Forskere har i årtier vidst, at en bestemt klasse af enzymer er en vigtig aktør inden for cellebiologi, fordi de ofte muterer og bliver væsentlige årsager til kræft.
Biofarmavirksomheder forsøger at udvikle lægemidler, der målretter mod og inaktiverer disse enzymer, kendt som phosphoinositide 3-kinase, eller PI3K for kort, på grund af deres rolle i at forårsage kræft hos mennesker. Men for at gøre det, videnskabsmænd har brug for en detaljeret plan for enzymarkitekturen, og UO biokemiprofessor Scott Hansen er en del af en gruppe, der afdækker det diagram.
Hansen, en adjunkt i UO Institut for Kemi og Biokemi, nævnte del af udfordringen er, at molekylerne er komplekse, med to store proteiner, der går sammen og danner et kompleks.
"Så det er virkelig udfordrende at finde ud af, hvad strukturen og organisationen af dette protein er, " sagde han. "En forudsætning for at udvikle et lægemiddel er at lære, hvordan stoffet binder til molekylet. Du har brug for en blåkopi af proteinet til at lægge det lægemiddel på."
Nu har Hansen og kolleger fra flere andre universiteter udviklet en sådan plan for PI3K og identificeret, hvor et kritisk regulatorisk protein binder til enzymet, et fund med potentiale til at hjælpe med at øge indsatsen for at bygge mere specifikke kræftlægemidler.
"Dette vil helt sikkert forme, hvordan folk tænker om at udvikle kræftterapi, " han sagde.
Hansen er en af 13 medforfattere på det papir, der er offentliggjort i tidsskriftet Videnskabens fremskridt , sammen med kolleger på universiteterne i Victoria, Britisk Columbia, Washington og Genève, og Vrije Universiteit Brussel i Belgien.
Det, der gør papiret unikt, er "strukturel information med højere opløsning og at være i stand til at måle biologisk relevante interaktioner med andre molekyler ved at definere sekvensen og prioriteten af interaktioner, sagde Hansen.
Men han sagde, at der er meget arbejde tilbage for bedre at forstå, hvordan andre molekyler binder til proteinet og modulerer dets funktion.
For at lære enzymets struktur, forskerne brugte en teknik kaldet kryo-elektronmikroskopi, som samler titusindvis af billeder af enkelte P13K-enzymer i et ultratyndt lag is ved hjælp af et elektronmikroskop. Billederne er kompileret og gennemsnittet for at skabe et enkelt billede i høj opløsning, der afslører enzymets strukturelle træk.
I dette tilfælde, enzymets struktur var anderledes end tidligere antaget. Den nye plan vil give forskere mulighed for at definere, hvordan andre molekyler aktiverer proteinet.
"Mange gange forsker vi, og vi får fingerpeg om, hvordan proteiner er organiseret, eller vi ser på strukturer af relaterede molekyler og ekstrapolerer, men nogle gange er disse antagelser unøjagtige og kan føre et felt ned ad den forkerte vej, "Hansen sagde. "At have en højere opløsning blueprint af organiseringen af molekyler giver folk mulighed for at udvikle lægemidler, der er specifikke for kun det molekyle."
Hansen sagde, at forskere involveret i papiret har brugt 10 år på at arbejde på problemet.
"Det er ikke ualmindeligt for rigtige komplicerede proteiner, " han sagde.
Hansen sagde, at hans laboratorium på UO og John Burkes laboratorium ved University of British Columbia udfører komplementær forskning. Burkes laboratorium bruger kryo-elektronmikroskopi til at få billeder i høj opløsning af molekyler, og Hansens laboratorium er i stand til at "lave mere dynamiske målinger, der giver os mulighed for at måle interaktionerne mellem dette enzym og andre faktorer, der er kritiske for aktivering."
Han sagde, at det er spændende at samarbejde med andre forskere, der har ekspertise på områder, som han ikke har.
"Mere og mere, for at vi kan nå vores forskningsambitioner, kan vi ikke kun stole på færdighederne i vores eget laboratorium, " sagde han. "Problemerne bliver for komplicerede, og du er nødt til at gribe dem an fra forskellige vinkler og integrere en masse forskellig ekspertise."
 Varme artikler
Varme artikler
-
 Forskere skaber fermenteret juice og funktionelt brød til behandling af anæmiKredit:South Ural State University (SUSU) Et team af russiske forskere fra South Ural State University og deres egyptiske kolleger fremstiller sunde funktionelle fødevarer. Brød og drikkevarer rig
Forskere skaber fermenteret juice og funktionelt brød til behandling af anæmiKredit:South Ural State University (SUSU) Et team af russiske forskere fra South Ural State University og deres egyptiske kolleger fremstiller sunde funktionelle fødevarer. Brød og drikkevarer rig -
 En bærbar, fritstående elektrokemisk sensorsystemFESS design begrundelse, implementering, og ansøgning. (A) skematisk af biomarkørinformationsleveringsvejen aktiveret af FESS, illustrerer prøveudtagning, sansning, og routing af epidermalt hentet bio
En bærbar, fritstående elektrokemisk sensorsystemFESS design begrundelse, implementering, og ansøgning. (A) skematisk af biomarkørinformationsleveringsvejen aktiveret af FESS, illustrerer prøveudtagning, sansning, og routing af epidermalt hentet bio -
 Forskere laver alkometer, der kan opdage marihuanaErvin Sejdic, PhD (til venstre) og Alexander Star, Ph.d., holde prototypen på deres THC-detekterende enhed op. Kredit:University of Pittsburgh Efterhånden som legalisering af rekreativ marihuana b
Forskere laver alkometer, der kan opdage marihuanaErvin Sejdic, PhD (til venstre) og Alexander Star, Ph.d., holde prototypen på deres THC-detekterende enhed op. Kredit:University of Pittsburgh Efterhånden som legalisering af rekreativ marihuana b -
 Ny teori kan føre til bedre batterier, brændstofcellerPå dette billede, forskellige farver repræsenterer den krystallografiske orientering af mikrometerstore korn, der udgør et materiale kaldet Yttria Stabilized Zirconia, bruges i brændselsceller og andr
Ny teori kan føre til bedre batterier, brændstofcellerPå dette billede, forskellige farver repræsenterer den krystallografiske orientering af mikrometerstore korn, der udgør et materiale kaldet Yttria Stabilized Zirconia, bruges i brændselsceller og andr
- 2-D oxidflager opfanger overraskende elektriske egenskaber
- Tre slags information fra en enkelt røntgenmåling
- Astronomer undersøger supermassive sorte hul i radiogalaksen PKS 2251+11
- Størrelsen bestemmer, hvordan nanopartikler påvirker biologiske membraner
- Sådan konverteres MPa til N /mm ^ 2
- Typen af Marine Growth


