En bærbar, fritstående elektrokemisk sensorsystem
FESS design begrundelse, implementering, og ansøgning. (A) skematisk af biomarkørinformationsleveringsvejen aktiveret af FESS, illustrerer prøveudtagning, sansning, og routing af epidermalt hentet biomarkørinformation til udlæsningselektronik gennem en enkelt enhed. (B) Designrationale for FESS. (C) Repræsentativ implementering af FESS, demonstrerer fleksibilitet og ingen sammenkobling i flyet. (D) Repræsentativ familie af FESS-enheder, indeholdende 1 × 2, 3 × 3, og 6 × 6 elektrodearrays. (E) Specialudviklet og FESS-aktiveret smartwatch til biomarkørovervågning. (F og G) Implementering af det FESS-aktiverede smartwatch i stationære (F) og højintensive træningsindstillinger (G). (Billedkredit:Peterson Nguyen, Kaili Chiu, Yichao Zhao, University of California, Los Angeles.) Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.aaz0007
I en ny undersøgelse offentliggjort på Videnskabens fremskridt , Yichao Zhao og et forskerhold inden for integreret bioelektronik og materialer og teknik i USA konstruerede en engang, fritstående elektrokemisk sensorsystem (FESS). FESS gav dem mulighed for at realisere en designstrategi på systemniveau for at løse udfordringerne for bærbare biosensorer i nærvær af bevægelse og muliggøre problemfri integration med forbrugerelektronik. Holdet udviklede et FESS-aktiveret smartwatch, med svedprøvetagning, elektrokemisk registrering og datavisning eller transmission, inden for en selvstændig bærbar platform. Holdet brugte FESS-smartwatchet til at overvåge profilerne af svedmetabolitter blandt personer i stillesiddende og højintensive træningsindstillinger.
Internet-of-things (IOT)-infrastrukturen kan bruges i bærbar forbrugerelektronik til at transformere personlig og præcis medicin ved at høste fysiologisk relevante data med minimal brugerindblanding. Forskere har typisk brugt fysiske sensorer i kommercielle bærbare platforme til at spore en brugers fysiske aktivitet og vitale tegn. Imidlertid, at få indsigt i kroppens dynamiske kemi, forskere kræver elektrokemiske sanseoverflader for at målrette biomarkørmolekylerne i ikke-invasivt hentede kropsvæsker såsom sved. For at opnå dette, det er afgørende at præcist konstruere informationsleveringsvejen fra huden til en udlæsningsenhed. Til elektrokemisk sensing, informationsleveringsvejen skal prøve og levere den biomarkørrige biovæske til sensoroverfladen i en mikrofluidisk struktur, efterfulgt af signaltransduktion gennem indbyrdes forbundne elementer til udlæsningselektronikken. Signalet skal opretholdes langs denne vej i nærvær af bevægelsesinduceret belastning.
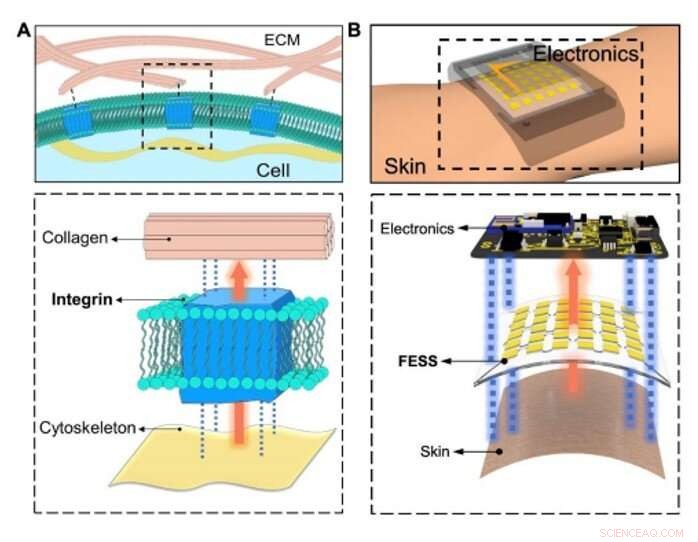
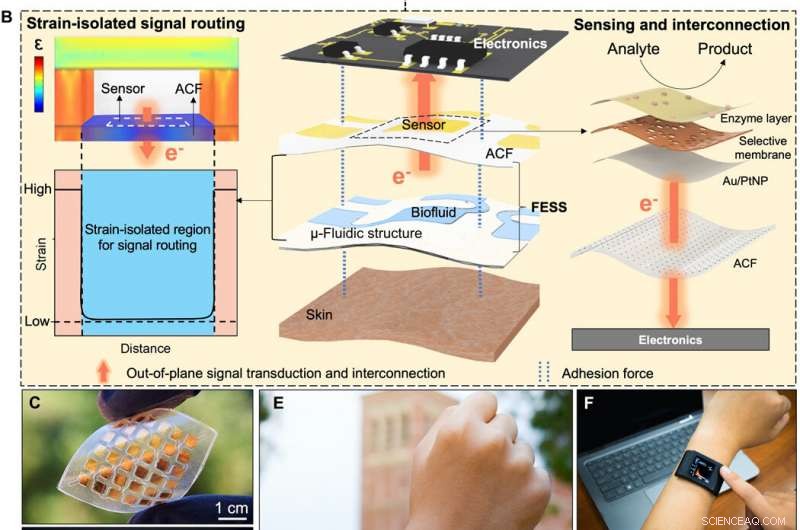
Bio-inspireret in situ sensing og signalsammenkobling. (A) Konceptuel illustration af den fysiologiske informationsudveksling mellem intracellulære/ekstracellulære matricer lettet af celleadhæsive molekyler (integrin) via sensing, ud af planet signalforbindelse, og dobbeltsidet vedhæftning. (B) In-situ sensing, ud af planet signalforbindelse, og dobbeltsidet vedhæftning muliggjort af FESS, som en enkelt enhed, placeret mellem hud og elektronik. Kredit:Science Advances, doi:10.1126/sciadv.aaz0007
I dette arbejde, Zhao et al. udviklede det fritstående elektrokemiske sensingsystem (FESS) og klæbede det samtidigt til huden og elektronikken ved hjælp af dobbeltsidede vedhæftningskræfter uden stive stik. FESS-prøvet og rettet epidermalt hentede biovæsker til elektrokemisk sensing, efterfulgt af routing til udlæsningselektronik gennem en belastningsisoleret vej. De integrerede FESS inde i et specialbygget smartwatch til svedinduktion, prøveudtagning, elektrokemisk sansning, signalbehandling og datavisning eller transmission. Resultaterne viste high-fidelity signaltransduktion og robust mekanisk kontakt med menneskelig hud uden at begrænse brugerens bevægelser. Det fritstående sensorsystem kan forbindes med fremtidig bærbar elektronik for at generere high-fidelity sundheds- og wellness-relaterede datasæt baseret på brugernes daglige aktiviteter.
At skabe en effektiv biologisk vej, Zhao et al. udvalgt integrin - et celleadhæsivt molekyle, der effektivt tillod fysiologisk informationsudveksling mellem intracellulære og ekstracellulære matricer. FESS-enheden implementerede integrinlignende funktionaliteter gennem en stamme-isoleret region i en mikrofluidisk struktur. De konstruerede FESS som en lodret ledende, dobbeltsidet klæbende og fleksibelt mikrofluidisk bioanalytisk tyndfilmsystem sammensat af flere vertikalt stablede film. Disse film omfattede en adhæsiv anisotropisk ledende film (ACF), en ædelmetal elektrode array film, en biokemisk film, en mikrofluidisk film og en hudklæbende film. De tapede det komplette tyndfilmsystem på udlæsningselektronikken uden stik og med minimal kontaktmodstand for potentielt at omdanne enhver elektrisk kontakt til en kemisk eller biologisk sensor. Teamet udviklede et proof-of-princip, selvstændigt biomarkør-sansende smartwatch med FESS til at overvåge svedmetabolitprofilerne hos individer i stillesiddende vs. høje træningsindstillinger.

FESS belastningssimulering og karakterisering af belastningsisoleret signalforbindelse. (A) Illustration af FESS 'signalforbindelse uden for flyet kontra konventionel in-plane signalforbindelse. Konventionelle implementeringer er begrænset til signalrouting gennem stærkt belastede områder, mens den udtænkte FESS muliggør routing via nær-nul belastningsområder. (B) COMSOL-simuleret tøjningsprofil (ε) af en repræsentativ FESS i nærværelse af en eksternt påført forskydningskraft, illustrerer næsten-nul belastning i bunden af mikrokanalen (dvs. substrat-biofluid grænseflade). (C) Tilsvarende zoomet visning af stamprofilen for en "pixel". (D) Deformationsfordeling langs den stiplede linje i (C). (E) Ud-af-planet sammenkobling elektrisk karakterisering af FESS udført under forskellige lokale bøjningsvinkler (for et array af 6 × 6 Au-elektroder). (F) Sammenkoblingsmodstande for den bøjede FESS-FPCB (RFESS + RFPCB), for forskellige lokale bøjningsvinkler (normaliseret i forhold til RFPCB uden bøjning, RFPCB, 0). Fejlbjælker angiver standardfejl for målinger på tværs af de seks elektroder i hver kolonne. (G) Modstandsmålinger af FESS-elektroderne under forskellige bøjningsvinkler (n =36), i forhold til FPCB-kontaktpudens modstand (RFPCB, 0). (H til J) 180° afskalningstest, der karakteriserer sammenkoblingsadhæsionen mellem PCB'et og FESS med forskellige bagsidestrukturer:mikrofluidisk base-ACF (H), mikrofluidisk kanal-ACF (I), og et repræsentativt mikrofluidisk kanalarray-ACF (J). (Fotokredit:Peterson Nguyen, University of California, Los Angeles.) Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.aaz0007
I denne opsætning, den vertikale ledningsevne af ACF lettede signalforbindelser ud af planet for at undgå uønskede kropsbevægelse-inducerede belastningseffekter på signalvejene. Holdet karakteriserede FESS's mekaniske adhæsionsegenskaber for at sikre, at adhæsionskræfterne mellem FESS og elektronikken var højere end dem mellem FESS og tør eller aktivt svedende hud. Holdet testede den kraft, der kræves for at skrælle ACF-laget fra FESS'en på et printkort, og resultaterne viste en stærk FESS-baseret sammenkobling til elektronik, som velegnet til applikationer på kroppen.
Zhao et al. testede derefter FESS'ens signaltransduktionsevne. De mønstrede ædelmetalelektroder på ACF for at opnå biokemisk-til-elektrisk signaltransduktion, efterfulgt af aflejring af biokemiske film for at analysere biomolekylære mål af interesse. De testede den elektrokemiske aktivitet af metalmønstret ACF for to almindeligt anvendte elektrodeoverflader på umodificeret guld (Au) og platin (Pt) nanopartikelmodificeret Au. De elektroanalytiske metoder, der blev undersøgt i arbejdet, leverede prøve-til-svar biomarkøraflæsninger for at opnå realtidsindsigt i ændringerne i svedbiokomposition.

Test af modstandsmålingen af de ACF-baserede forbindelser efter mekanisk deformation. Kredit:Science Advances, doi:10.1126/sciadv.aaz0007
I de næste par eksperimenter, forskergruppen viste FESS 'evne til at overvåge biomarkører under brugerens daglige aktiviteter. For at opnå dette, de integrerede FESS i et specialudviklet smartwatch som en model IOT-enhed indeholdende et analogt/digitalt kredsløb, Bluetooth-transceiver og en LCD-skærm (liquid crystal display) til funktioner på systemniveau, herunder signal- og brugerkommandobehandling, display og trådløs datakommunikation. Det FESS-baserede smartwatch fungerede på samme måde som en potentiostat. Forskerne klæbte det komplette smartwatch fast på huden uden eksterne indpakninger eller armaturer til trådløs biomarkørføling som en selvstændig enhed. LCD-skærmen viste realtidsaflæsninger og tidsmæssig profil af biomarkørmålingerne, mens Bluetooth-modtageren videresendte aflæsningerne til en specialudviklet mobilapplikation for at uploade dataene til en cloud-server for yderligere analyse.
Holdet klæbte det FESS-baserede smartwatch på et forsøgspersons underarm for at vise dets funktion som et bærbart system til at overvåge biomarkører. Emnet kunne trådløst styre enheden til at tage realtid, svedbaserede biomarkørmålinger i forhold til brugerens daglige rutine. Brugeren overvågede deres svedglukoseniveauer før eller efter indtagelse af et blandet udvalg af måltider, og udlæsningen af smartwatchet indikerede forhøjede svedglukoseniveauer efter fødeindtagelse, i overensstemmelse med tidligere tendenser. Smartwatchet gav desuden brugeroplysninger om svedlaktataflæsninger, mens du løb på en mark, resultaterne var konsistente på trods af involvering af højfrekvente og højaccelerationsbaserede kropsbevægelser.
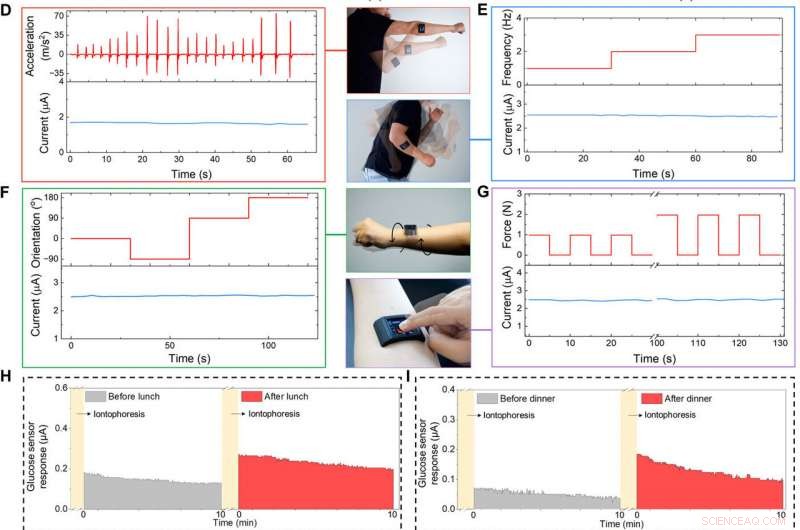
Specialudviklet FESS-integreret smartwatch til påføring på kroppen. (A) Illustration af det FESS-aktiverede smartwatch (indeholdende FESS, LCD skærm, PCB, og batterienheder anbragt i et 3D-printet etui). (B og C) Ex situ karakterisering af FESS-PCB glukosesensorsystemets respons på hvirvelvibrationer (FESS elektrode:6 mm2, mikrofluid kanalhøjde:170 μm, og volumen:4 pi). Vibrationsaccelerationsprofilerne er vist i den øverste halvdel, og sensorresponserne fanges i den nederste halvdel, når de testes i PBS (B) og 100 μM glucose i PBS (C). (D til G) On-body signaltroskabskarakterisering af et FESS-PCB laktatsensorsystem med et emne, der udfører skyggeboksning (D), svingende arm (E), vridning af håndled (F), og enheden trykker på (G). Accelerationen, frekvens, orientering, og kraftprofiler vises i den øverste halvdel, og sensorresponser fanges i den nederste halvdel. (H til J) Overvågning af forsøgspersonernes metabolitprofiler gennem forskellige daglige begivenheder og i forskellige indstillinger. Iontoforetisk induceret svedglukose blev målt før og efter frokost (H) og aftensmad (I). (J) Målinger af svedlaktat under træning (en repræsentativ bevægelsesinduceret accelerationsprofil er vist til højre). (Fotokredit:Peterson Nguyen, Kaili Chiu, og Yichao Zhao, University of California, Los Angeles.) Kredit: Videnskabens fremskridt , doi:10.1126/sciadv.aaz0007
På denne måde Yichao Zhao og kolleger undersøgte biomarkørinformations-leveringsvejen og genkendte tæt-nul-spændte områder inde i et mikrofluidisk-sensing-modul for at konstruere en stamme-isoleret sti for at bevare troværdigheden af biomarkørdata. Tyndfilmssystemet, der dannede den fritstående FESS-entitet, var bioinspireret af integrinlignende funktionaliteter til signaltransduktion og signalforbindelse via dobbeltsidet adhæsion. FESS'en slog effektivt bro mellem huden og udlæsningselektronikken for at høste biomarkørinformation. Holdet koblede FESS-systemet problemfrit med et specialudviklet smartwatch som en bærbar biosensor til at overvåge biomarkørudlæsninger i realtid gennem en brugers daglige rutine. For at kommercialisere prototypen udviklet i dette arbejde, Zhao et al. foreslå fremtidige kliniske forsøg for at kortlægge svedbaserede biomarkøraflæsninger og få information om brugernes fysiologiske status. Fordelene ved dette arbejde, herunder deres lette integration med bærbar elektronik og high fidelity-aflæsninger kan bruges til at udføre store kliniske undersøgelser.
© 2020 Science X Network
 Varme artikler
Varme artikler
-
 Bladlusstressede fyrretræer viser forskellig sekundær organisk aerosoldannelseKredit:American Chemical Society Planter udsender gasser, kaldet flygtige organiske forbindelser (VOCer), der kommer ind i atmosfæren, hvor de kan interagere med andre naturlige og menneskeskabte
Bladlusstressede fyrretræer viser forskellig sekundær organisk aerosoldannelseKredit:American Chemical Society Planter udsender gasser, kaldet flygtige organiske forbindelser (VOCer), der kommer ind i atmosfæren, hvor de kan interagere med andre naturlige og menneskeskabte -
 Forskere skaber ny aluminiumslegering med fleksibilitet, styrke, lethedDetaljer lavet af Al-Ni-La kompositmateriale Kredit:© Sergey Gnuskov/NUST MISIS Aluminium er et af de mest lovende materialer til luftfarts- og bilindustrien. Forskere fra National University of S
Forskere skaber ny aluminiumslegering med fleksibilitet, styrke, lethedDetaljer lavet af Al-Ni-La kompositmateriale Kredit:© Sergey Gnuskov/NUST MISIS Aluminium er et af de mest lovende materialer til luftfarts- og bilindustrien. Forskere fra National University of S -
 En lavtemperaturmetode til fremstilling af højtydende termoelektriske materialerMohamad Nugraha (til venstre) og hans gruppeleder, Derya Baran, demonstrere enhedens fleksibilitet. Kredit:KAUST Noget af den enorme mængde spildte energi, som maskiner og enheder udsender som var
En lavtemperaturmetode til fremstilling af højtydende termoelektriske materialerMohamad Nugraha (til venstre) og hans gruppeleder, Derya Baran, demonstrere enhedens fleksibilitet. Kredit:KAUST Noget af den enorme mængde spildte energi, som maskiner og enheder udsender som var -
 Styring og visualisering af receptorsignaler i neurale celler med lysDennis Eickelbeck (tv) og Stefan Herlitze får cellerne til at lyse-med såkaldt optogenetik. Kredit:RUB, Marquard Ved hjælp af et nyt optogenetisk værktøj, forskere har med succes kontrolleret, gen
Styring og visualisering af receptorsignaler i neurale celler med lysDennis Eickelbeck (tv) og Stefan Herlitze får cellerne til at lyse-med såkaldt optogenetik. Kredit:RUB, Marquard Ved hjælp af et nyt optogenetisk værktøj, forskere har med succes kontrolleret, gen


