I en siliciumkrystall. Hvor mange kovalente bindinger dannes den enkelte atom?
Her er hvorfor:
* Silicons elektroniske konfiguration: Silicium har fire valenselektroner (elektroner i sin yderste skal).
* kovalent binding: Silicium opnår en stabil oktetkonfiguration ved at dele sine fire valenselektroner med fire nærliggende siliciumatomer.
* tetrahedral struktur: Dette resulterer i en tredimensionel, tetrahedral struktur, hvor hvert siliciumatom er bundet til fire andre.
Dette stærke kovalent bindingsnetværk er ansvarlig for de unikke egenskaber ved silicium, inklusive dets høje smeltepunkt, hårdhed og evne til at udføre elektricitet under specifikke forhold.
Sidste artikelHvad er opløsningsmidlet af tinkturjod?
Næste artikelHvad er massen på 0,25 mol nitrationer?
 Varme artikler
Varme artikler
-
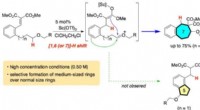 Forskere udvikler metode til at forbedre skelettet af almindelige kemikalierForskere i Japan udviklede en ny metode til at producere mere komplicerede og mellemstore (syv- og otte-leddede) carbocycles. Kredit:Keiji Mori, TUAT Ethvert kemikalie, fra det enkleste til det me
Forskere udvikler metode til at forbedre skelettet af almindelige kemikalierForskere i Japan udviklede en ny metode til at producere mere komplicerede og mellemstore (syv- og otte-leddede) carbocycles. Kredit:Keiji Mori, TUAT Ethvert kemikalie, fra det enkleste til det me -
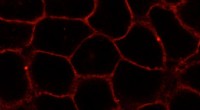 Hvordan forskere analyserer cellemembranerEn ny forbindelse, der efterligner naturligt kolesterol i membraner af levende celler (her:HeLa-celler). Stoffet er mærket med et fluorescerende farvestof (rødt). Kredit:L. Rakers et al./ Cell Chem B
Hvordan forskere analyserer cellemembranerEn ny forbindelse, der efterligner naturligt kolesterol i membraner af levende celler (her:HeLa-celler). Stoffet er mærket med et fluorescerende farvestof (rødt). Kredit:L. Rakers et al./ Cell Chem B -
 Kend din cement, få grønnere betonBeton er det mest brugte byggemateriale i verden - dets fremstilling bidrager med så meget som 8 procent af kuldioxiden til atmosfæren. Kredit:Eugenesergeev, iStock Et internationalt hold af forsk
Kend din cement, få grønnere betonBeton er det mest brugte byggemateriale i verden - dets fremstilling bidrager med så meget som 8 procent af kuldioxiden til atmosfæren. Kredit:Eugenesergeev, iStock Et internationalt hold af forsk -
 Heterogen ethylenhydroformylering muliggør højeffektiv industriel produktion af propanal/n-propano…Den industrielle facilitet med 50 kt/år propanal/n-propanol ved heterogen ethylenhydroformylering. Kredit:LI Cunyao Olefiner, hydrogen og carbonmonoxid kan omdannes til aldehyder ved hydroformyleri
Heterogen ethylenhydroformylering muliggør højeffektiv industriel produktion af propanal/n-propano…Den industrielle facilitet med 50 kt/år propanal/n-propanol ved heterogen ethylenhydroformylering. Kredit:LI Cunyao Olefiner, hydrogen og carbonmonoxid kan omdannes til aldehyder ved hydroformyleri


