Hvor mange gram nitrogendioxid skal reagere med vand for at producere 5,00x10 22 molekyler monoxid?
1. Afbalanceret kemisk ligning:
Den afbalancerede kemiske ligning for reaktionen er:
3 NO₂ (G) + H₂O (L) → 2 HNO₃ (AQ) + NO (G)
2. Mol-til-mol-forhold:
Fra den afbalancerede ligning ser vi, at 3 mol NO₂ reagerer på at producere 1 mol NO.
3. Konverter molekyler til mol:
* Vi har 5,00 x 10²² molekyler af NO.
* Avogadros nummer fortæller os, at der er 6,022 x 10²³ molekyler i en mol.
* Mol No =(5,00 x 10²² molekyler) / (6,022 x 10²³ molekyler / mol) =0,0830 mol NO
4. Beregn mol på NO₂:
* Brug af molforholdet fra den afbalancerede ligning:
Mol NO₂ =0,0830 mol NO * (3 mol NO₂ / 1 Mol NO) =0,249 Mol NO₂
5. Konverter mol af NO₂ til gram:
* Den molære masse på NO₂ er 14,01 g/mol (n) + 2 * 16,00 g/mol (O) =46,01 g/mol
* Gram No₂ =0,249 Mol No₂ * 46,01 g/mol =11,4 g No₂
Derfor har du brug for ca. 11,4 gram nitrogendioxid for at reagere med vand for at producere 5,00 x 10²² molekyler nitrogenmonoxid.
Sidste artikelHvor mange partikler er der i en mol nitrogendioxid?
Næste artikelHvad er atomantallet af calciumsulfat?
 Varme artikler
Varme artikler
-
 Ny undersøgelse sætter usædvanlig retsmedicinsk efterforskningsteknik på prøveByrne testede slim blandet med reagenskemikalier for at afgøre, om blandingen var effektiv til at afsløre svære at se fingeraftryk. Kredit:Leanne Byrne Kunne husholdningsslim blive et værktøj til
Ny undersøgelse sætter usædvanlig retsmedicinsk efterforskningsteknik på prøveByrne testede slim blandet med reagenskemikalier for at afgøre, om blandingen var effektiv til at afsløre svære at se fingeraftryk. Kredit:Leanne Byrne Kunne husholdningsslim blive et værktøj til -
 Lyser vejen til porøs elektronik og sensorerFig.1 Nanostruktur porøs titaniumoxid tynd film (TiOx) aflejret på plast (PI:polyimid) substratet. Kredit:Osaka University Mange almindelige husholdningsartikler og enheder har en belægning, der f
Lyser vejen til porøs elektronik og sensorerFig.1 Nanostruktur porøs titaniumoxid tynd film (TiOx) aflejret på plast (PI:polyimid) substratet. Kredit:Osaka University Mange almindelige husholdningsartikler og enheder har en belægning, der f -
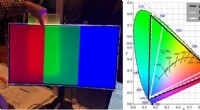 Oprettelse af skærme med rigere farver(Venstre) Foto, der viser farveforbedringseffekten ved brug af en prototype af den perovskitbaserede film. Når filmen placeres mellem baggrundsbelysningsenheden og skærmen, en spektral renere rød og g
Oprettelse af skærme med rigere farver(Venstre) Foto, der viser farveforbedringseffekten ved brug af en prototype af den perovskitbaserede film. Når filmen placeres mellem baggrundsbelysningsenheden og skærmen, en spektral renere rød og g -
 Undersøgelse undersøger oxidvækst i additivt fremstillede metaller i et superkritisk kuldioxidmil…Kredit:CC0 Public Domain En ny fælles undersøgelse fra Southwest Research Institute og Sandia National Laboratories undersøger forskellene i oxidfilmvækst på additivt fremstillede (AM) metaller og
Undersøgelse undersøger oxidvækst i additivt fremstillede metaller i et superkritisk kuldioxidmil…Kredit:CC0 Public Domain En ny fælles undersøgelse fra Southwest Research Institute og Sandia National Laboratories undersøger forskellene i oxidfilmvækst på additivt fremstillede (AM) metaller og
- Nanoneedle-gennembrud giver håb om billigere kræftbehandling
- Hvad er det kemiske navn på jernmalm?
- Et nyt strækbart batteri kan drive bærbar elektronik
- Apple tilbagekalder frivilligt batterier på MacBook Pro notebooks på grund af sikkerhedsrisiko. Hv…
- Japan leder efter overlevende, da tyfonen Hagibis-dødstallet rammer 56
- Temperaturområdet for hver større klimazone er baseret på dens?


