Hvordan får du brint- og iltgasser fra H2O?
Elektrolyse af vand
1. opsætning:
- Du har brug for en beholder med vand, to elektroder (metalstænger), en strømkilde (som et batteri) og nogle ledninger til at forbinde alt.
- Elektroderne er normalt lavet af inerte materialer som platin eller kulstof, så de ikke reagerer med vandet.
- Elektroderne er nedsænket i vandet og forbundet til de positive og negative terminaler i strømkilden.
2. Processen:
- Når en elektrisk strøm passerer gennem vandet, nedbrydes vandmolekylerne i deres bestanddele, brint og ilt.
- Ved den negative elektrode (katode) får vandmolekyler elektroner og reduceres til brintgas (H2).
- Ved den positive elektrode (anode) mister vandmolekyler elektroner og oxideres til iltgas (O2).
3. reaktionen:
- Den samlede kemiske reaktion til elektrolyse af vand er:
2H2O (L) → 2H2 (G) + O2 (G)
- Dette betyder, at du for hver to molekyler vand får to molekyler med brintgas og et molekyle af iltgas.
Nøglepunkter:
* jævnstrøm: Elektrolyse kræver en jævnstrøm (DC) strømkilde.
* elektrolyt: For at forbedre ledningsevnen tilsættes en lille mængde elektrolyt som svovlsyre eller natriumhydroxid ofte til vandet.
* Gasser samling: De producerede brint- og iltgasser kan opsamles separat ved hjælp af inverterede reagensglas eller andre passende opsamlingsmetoder.
sikkerhed:
* elektrolyse kan producere brandfarlig brintgas. Håndter brint med forsigtighed og sikre tilstrækkelig ventilation.
* elektrolytopløsninger kan være ætsende. Brug passende sikkerhedsudstyr og følg ordentlige håndteringsprocedurer.
Ansøgninger:
Elektrolyse af vand bruges i forskellige anvendelser, herunder:
* Produktion af brintgas: Hydrogen bruges som brændstof, i brændselsceller og i industrielle processer.
* Produktion af iltgas: Oxygen bruges på hospitaler, svejsning og andre industrielle processer.
* Forskning og uddannelse: Elektrolyse er et værdifuldt værktøj til at demonstrere grundlæggende principper for kemi og elektrokemi.
Sidste artikelHvilken type binding dannes mellem nitrogen og brom?
Næste artikelEr egenskaberne ved klor det samme som natriumchlorid?
 Varme artikler
Varme artikler
-
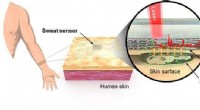 Hurtig, pålidelig lægemiddeldetektion på stedet ved hjælp af en bærbar sensorMedikamentdetektion i realtid ved hjælp af en optisk sensor fastgjort til den menneskelige hud. Kredit:Korea Institute of Materials Science (KIMS) Forskere i Sydkorea har med succes udviklet en bæ
Hurtig, pålidelig lægemiddeldetektion på stedet ved hjælp af en bærbar sensorMedikamentdetektion i realtid ved hjælp af en optisk sensor fastgjort til den menneskelige hud. Kredit:Korea Institute of Materials Science (KIMS) Forskere i Sydkorea har med succes udviklet en bæ -
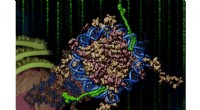 Programmering af syntetiske molekylære koder for at tænde generEn syntetisk molekylær kode kaldet Bi-PIP er blevet designet, som omfatter en hæmmer af et epigenetisk læserbromodæne og selektive DNA-bindende pyrrol-imidazolpolyamider. Bi-PIPet skrev en biomimetisk
Programmering af syntetiske molekylære koder for at tænde generEn syntetisk molekylær kode kaldet Bi-PIP er blevet designet, som omfatter en hæmmer af et epigenetisk læserbromodæne og selektive DNA-bindende pyrrol-imidazolpolyamider. Bi-PIPet skrev en biomimetisk -
 Hudplaster uden smerter opsamler væske til diagnostisk testDenne mikronålsplaster kan opsamle interstitiel væske på plasmonisk papir til analyse. Kredit:Tilpasset fra ACS -sensorer 2019, DOI:10.1021/acssensorer. 9b00258 Selvom blod indeholder et væld af
Hudplaster uden smerter opsamler væske til diagnostisk testDenne mikronålsplaster kan opsamle interstitiel væske på plasmonisk papir til analyse. Kredit:Tilpasset fra ACS -sensorer 2019, DOI:10.1021/acssensorer. 9b00258 Selvom blod indeholder et væld af -
 Bygge vægge, der vil gøre sommerens hedebølger mere tålelige(a) PCM-vægtværsnit (b) temperaturmålingsposition. Kredit:Korea Institute of Science and Technology (KIST) Med sommervarmen, der bliver mere og mere uudholdelig og langvarig på grund af klimaændri
Bygge vægge, der vil gøre sommerens hedebølger mere tålelige(a) PCM-vægtværsnit (b) temperaturmålingsposition. Kredit:Korea Institute of Science and Technology (KIST) Med sommervarmen, der bliver mere og mere uudholdelig og langvarig på grund af klimaændri
- Sådan identificeres vilde kirsebærtræer <p> <p> Det sorte kirsebærtræ fra slægten Prunus er og…
- Hvad hvis jeg glemte at fjerne en piercing før en MR?
- Hvor længe har der været mennesker, der bor i Space Center på Moon?
- Hvornår under lysreaktionen er vandmolekyle opdeling?
- Hvor mange mol atomer i 4,2 gange 10 til de 24. PB -atomer?
- Forbud mod plastikposer, by for by:En guide


