Når 1,326 g af et metalsulfid blev ristet i luft 0,824 oxid dannet, hvis oxidationsnummeret er 2, hvad molmasse metal?
1. Skriv den afbalancerede kemiske ligning
Den generelle reaktion til at stege et metalsulfid er:
2 ms + 3 o₂ → 2 mo + 2 so₂
Hvor:
* M er metallet
* S er svovl
* O er ilt
2. Beregn massen af svovl mistet
* Masse sulfid =1.326 g
* Masse oxid =0,824 g
* Mass af svovl mistet =masse af sulfid - masse af oxid =1,326 g - 0,824 g =0,502 g
3. Beregn molen af svovl mistet
* Molær masse svovl (r) =32,06 g/mol
* Mol svovl =masse svovl / molmasse svovl =0,502 g / 32,06 g / mol =0,0156 mol
4. Beregn molen af dannet metaloxid
* Fra den afbalancerede ligning producerer 2 mol MS 2 mol MO.
* Derfor er molen af dannet metaloxid lig med molen af tabt svovl:0,0156 mol.
5. Beregn massen af dannet metaloxid
* Mol metaloxid =0,0156 mol
* Masse af metaloxid =0,824 g (givet)
* Molmasse af metaloxid =masse af metaloxid / mol af metaloxid =0,824 g / 0,0156 mol =52,82 g / mol
6. Beregn den molære masse af metallet
* Molmasse af metaloxid (MO) =molmasse af metal (M) + molmasse af ilt (O)
* Molmasse ilt (O) =16,00 g/mol
* Molmasse af metal (m) =molmasse af metaloxid - Molmasse af ilt =52,82 g/mol - 16,00 g/mol =36,82 g/mol
Derfor er metalens molære masse ca. 36,82 g/mol.
Bemærk: Oxidationsnummeret på metallet er angivet som +2, hvilket er i overensstemmelse med den generelle formel for metalsulfider (MS) og oxider (MO). Disse oplysninger er ikke nødvendige for den faktiske beregning, men hjælper med at verificere den antagede kemiske ligning.
 Varme artikler
Varme artikler
-
 Biomedicinske polymerer:syntese, egenskaber og anvendelserSkematisk illustration af smarte polymerer til biomedicinske applikationer. Kredit:Science China Press Biomedicinske polymerer er blevet omfattende udviklet til lovende anvendelser inden for en mas
Biomedicinske polymerer:syntese, egenskaber og anvendelserSkematisk illustration af smarte polymerer til biomedicinske applikationer. Kredit:Science China Press Biomedicinske polymerer er blevet omfattende udviklet til lovende anvendelser inden for en mas -
 Foto-induceret ionforskydning i blandede halogenidperovskitter til et batteri, der kan oplades direk…PL-emissionskortlægning af MA0.17FA0.83Pb(I0.5Br0.5)3 ved detektionsbølgelængden på 670 nm og 790 nm efter lokal belysning i 1 time med en strålestørrelse på ~ 1 mm og tæthed på 1 sol på den bare film
Foto-induceret ionforskydning i blandede halogenidperovskitter til et batteri, der kan oplades direk…PL-emissionskortlægning af MA0.17FA0.83Pb(I0.5Br0.5)3 ved detektionsbølgelængden på 670 nm og 790 nm efter lokal belysning i 1 time med en strålestørrelse på ~ 1 mm og tæthed på 1 sol på den bare film -
 Bliv begejstret af neurale netværkForskere ved University of Tokyo bruger maskinlæring til at forudsige materialets ophidsede elektroniske tilstande-forskning, der kan fremskynde både karakterisering af materialer såvel som formulerin
Bliv begejstret af neurale netværkForskere ved University of Tokyo bruger maskinlæring til at forudsige materialets ophidsede elektroniske tilstande-forskning, der kan fremskynde både karakterisering af materialer såvel som formulerin -
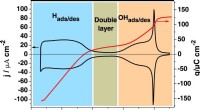 Ny forståelse af nøglebrændselscellekatalysatorTopmoderne for Pt(111). Cyklisk voltammogram (sort linje, venstre akse) og ladningstæthedskurve (rød linje, højre akse) for Pt (111) optaget i 0,1 M HClO4-opløsning ved en scanningshastighed på 50 mV
Ny forståelse af nøglebrændselscellekatalysatorTopmoderne for Pt(111). Cyklisk voltammogram (sort linje, venstre akse) og ladningstæthedskurve (rød linje, højre akse) for Pt (111) optaget i 0,1 M HClO4-opløsning ved en scanningshastighed på 50 mV
- Hvornår og hvorfor begyndte mennesker at bruge gravsten?
- Falske nyheder kan give bagslag for virksomheder, der er taget på fersk gerning
- Forskere løser mysteriet om, hvordan gasbobler dannes i væske
- Hvordan ændres vandtabellen med topografi (under en bakke eller under dalen)?
- Hvilken model beskriver karakteristikken ved cellemembranen?
- Hvad er Forest Stewardship Council -certificering?


