Kraften af tiltrækning efter gruppe 1 -metaller for deres valenselektroner er?
* stor atomstørrelse: Gruppe 1 -metaller har de største atomradier i deres respektive perioder. Dette betyder, at deres valenselektroner er længere væk fra kernen og oplever mindre elektrostatisk attraktion.
* kun en valenselektron: Gruppe 1 -metaller har en enkelt valenselektron. Denne elektron holdes løst og taber let, hvilket gør metallerne meget reaktive og gode ledere af elektricitet.
* afskærmningseffekt: De indre kerneelektroner beskytter valenselektronen mod den positive ladning af kernen. Denne afskærmningseffekt reducerer tiltrækningen mellem kernen og valenselektronen.
Konsekvenser af svag tiltrækning:
* Lav ioniseringsenergier: Gruppe 1 -metaller har de laveste ioniseringsenergier blandt alle elementer. Dette betyder, at det kræver meget lidt energi at fjerne deres valenselektron.
* Høj reaktivitet: Tendensen til let at miste deres valenselektron gør gruppe 1 -metaller meget reaktive, især med vand.
* Metallisk binding: Den svage attraktion mellem kernen og valenselektroner muliggør delokalisering af elektroner inden i metallet, hvilket fører til stærk metallisk binding.
Sammenfattende resulterer kombinationen af stor atomstørrelse, en enkelt valenselektron og afskærmningseffekter i en meget svag tiltrækningskraft mellem gruppe 1 -metaller og deres valenselektroner.
Sidste artikelHvor mange mol er 142 gram klorgas?
Næste artikelLadningen på en chloridion i AICI3 er?
 Varme artikler
Varme artikler
-
 Ny supramolekylær plast, der er nedbrydelig og yderst genanvendeligKredit:Pixabay/CC0 Public Domain En forskergruppe ledet af seniorforsker Jianwei Li ved MediCity Research Laboratory har udforsket en ny type materialer kaldet supramolekylær plast, der ville ersta
Ny supramolekylær plast, der er nedbrydelig og yderst genanvendeligKredit:Pixabay/CC0 Public Domain En forskergruppe ledet af seniorforsker Jianwei Li ved MediCity Research Laboratory har udforsket en ny type materialer kaldet supramolekylær plast, der ville ersta -
 Ny membranteknologi til at øge vandrensning og energilagringEt redox -strømbatteri, der kan skaleres op til energilagring i netskala. Kredit:Qilei Song, Imperial College London Imperial College London forskere har skabt en ny type membran, der kan forbedre
Ny membranteknologi til at øge vandrensning og energilagringEt redox -strømbatteri, der kan skaleres op til energilagring i netskala. Kredit:Qilei Song, Imperial College London Imperial College London forskere har skabt en ny type membran, der kan forbedre -
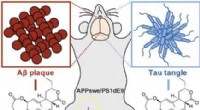 Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo
Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo -
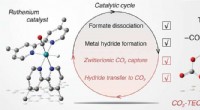 Overvågning af mellemprodukter i CO2 -omdannelse til formiat ved hjælp af metalkatalysatorTriethanolamin (TEOA) er aktivt engageret i centrale reaktionstrin i den fotokatalytiske cyklus til omdannelse af kuldioxid (CO2) af rutheniumcarbonylkomplekser. Kredit: Journal of the American Chemic
Overvågning af mellemprodukter i CO2 -omdannelse til formiat ved hjælp af metalkatalysatorTriethanolamin (TEOA) er aktivt engageret i centrale reaktionstrin i den fotokatalytiske cyklus til omdannelse af kuldioxid (CO2) af rutheniumcarbonylkomplekser. Kredit: Journal of the American Chemic
- Engineering team udvikler ny tilgang til at begrænse blyforurening i vand
- Forskere udvikler bærbar 3-D hudprinter til at reparere dybe sår
- EU, Kina sætter fokus på klimakampen, efter at USA har forladt Paris-aftalen
- Hvad betyder -ose i videnskabeligt ordforråd?
- Hvad er den kemiske formel for lithiumoxygen?
- Forskere fandt beviser på, hvorfor kvindelige havskildpadder altid vender tilbage til deres fødest…


