Hvilket af følgende ville være mest opløselige eller blandbare i CBR4, og hvilken vil mere vand A. NaCl B. HCl C. CH3OH D. CH4 E. C2H6?
Forståelse af opløselighed
* "som opløser som" :Dette princip siger, at stoffer med lignende polariteter er mere tilbøjelige til at opløses i hinanden.
* polaritet :Polære molekyler har ujævne fordelinger af elektrondensitet, hvilket skaber delvis positive og negative ladninger. Ikke -polære molekyler har en relativt jævn fordeling af elektrondensitet.
analyse af forbindelserne
* CBR4 (carbon tetrabromide): CBR4 er et ikke -polært molekyle på grund af det symmetriske arrangement af bromatomerne omkring det centrale kulstof.
* vand (H2O): Vand er et meget polært molekyle på grund af den bøjede form og det elektronegative iltatom.
Lad os analysere hver mulighed:
a. NaCl (natriumchlorid): Ionisk forbindelse, meget polær, opløses i vand (på grund af stærke ion-dipol-interaktioner). Det opløses ikke i CBR4.
b. HCI (hydrogenchlorid): Polært molekyle på grund af elektronegativitetsforskellen mellem brint og klor. Det vil være lidt opløseligt i vand og endnu mindre opløseligt i CBR4.
c. CH3OH (methanol): Polært molekyle på grund af tilstedeværelsen af en hydroxylgruppe (-OH). Det vil være opløseligt i vand (hydrogenbinding) og lidt opløselig i CBR4.
d. CH4 (metan): Ikke -polært molekyle. Det vil være mere opløseligt i CBR4 (på grund af lignende ikke -polære interaktioner) og praktisk talt uopløselig i vand.
e. C2H6 (ethan): Ikke -polært molekyle. Det vil være mere opløseligt i CBR4 (på grund af lignende ikke -polære interaktioner) og praktisk talt uopløselig i vand.
Konklusion
* mest opløselig i CBR4: CH4 og C2H6 (på grund af lignende ikke -polær karakter)
* mest opløselige i vand: NaCl (på grund af stærke ion-dipol-interaktioner)
Vigtig note: Opløselighed er et komplekst fænomen og kan påvirkes af forskellige faktorer (temperatur, tryk osv.). Ovenstående analyse giver en generel forståelse af opløselighedstendenser baseret på polaritet.
Sidste artikelHvis den samlede masse af produkter en reaktion er 250 g, hvad var reaktanter?
Næste artikelHvorfor er svovl en god isolator?
 Varme artikler
Varme artikler
-
 Ingeniører udvikler smart materiale, der ændrer stivhed, når det drejes eller bøjesEksempler på det nye smarte materiale, venstre mod højre:En fleksibel strimmel; en fleksibel strimmel, der stivnede, når den blev snoet; en fleksibel strimmel omdannet til en hård komposit, der kan ho
Ingeniører udvikler smart materiale, der ændrer stivhed, når det drejes eller bøjesEksempler på det nye smarte materiale, venstre mod højre:En fleksibel strimmel; en fleksibel strimmel, der stivnede, når den blev snoet; en fleksibel strimmel omdannet til en hård komposit, der kan ho -
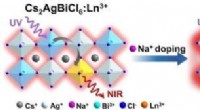 Effektiv nær-infrarød luminescens i lanthanid-doterede, helt uorganiske halogenid-dobbeltperovskit…Grafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202205276 Pb-fri alle-uorganiske halogenid-dobbeltperovskiter (DPer) er dukket op som en vigtig klasse af m
Effektiv nær-infrarød luminescens i lanthanid-doterede, helt uorganiske halogenid-dobbeltperovskit…Grafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202205276 Pb-fri alle-uorganiske halogenid-dobbeltperovskiter (DPer) er dukket op som en vigtig klasse af m -
 Fra gamle jeans til ny T-shirtviklet op på en spole, viskosefilamentgarnet blev spundet af genbrugsbomuld tilvejebragt i form af celluloseark. Forskere ved Fraunhofer IAP har fundet en måde at forvandle bomuldstøj som jeans til ny
Fra gamle jeans til ny T-shirtviklet op på en spole, viskosefilamentgarnet blev spundet af genbrugsbomuld tilvejebragt i form af celluloseark. Forskere ved Fraunhofer IAP har fundet en måde at forvandle bomuldstøj som jeans til ny -
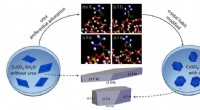 Virkningen af urinstofadditiver på krystallers fysisk -kemiske egenskaberSkematisk illustration af virkningen af urinstofadditiv på CuSO 4 · 5H 2 O krystalvane. Kredit:Prof. ZHUANGs gruppe) Krystalvaner har en betydelig indvirkning på krystallers fysisk -kemiske
Virkningen af urinstofadditiver på krystallers fysisk -kemiske egenskaberSkematisk illustration af virkningen af urinstofadditiv på CuSO 4 · 5H 2 O krystalvane. Kredit:Prof. ZHUANGs gruppe) Krystalvaner har en betydelig indvirkning på krystallers fysisk -kemiske
- Ny forskning kaster lys over, hvordan døgnrytmer fungerer
- Studerende stressede over college? Det kan hjælpe at sende sms'er til mor eller far
- Fremstilling af bøjelig is ved at dyrke enkeltkrystalmikrofibre
- Definition af syreopløsning
- Højfølsom visualisering af ultrahurtig bærerdiffusion ved bredfelt holografisk mikroskopi
- Brande stiger i brasiliansk Amazon i juli


