Hvorfor er svovl en god isolator?
* Elektronisk struktur: Svovlatomer har seks valenselektroner. Mens de kan danne kovalente bindinger, har de også relativt løst holdt elektroner i deres ydre skal. Disse elektroner kan let ophidses og bidrage til elektrisk ledningsevne.
* Krystallinsk struktur: Svovl findes i forskellige allotroper, hvoraf nogle har relativt svage intermolekylære kræfter. Disse svagere bindinger giver mulighed for en vis mobilitet af elektroner, hvilket yderligere bidrager til konduktivitet.
* urenheder: Selv i sin reneste form kan svovl indeholde sporforureninger, der kan forbedre dens ledningsevne.
Gode isolatorer: Materialer som gummi, glas og visse plast betragtes som gode isolatorer, fordi:
* stærke kovalente obligationer: Deres atomer holdes sammen af stærke kovalente bindinger, hvilket gør det meget vanskeligt for elektroner at bevæge sig frit.
* Fyldte valensskaller: Deres valensskaller er fyldt med elektroner, hvilket betyder, at de er tæt bundet og mindre tilbøjelige til at deltage i elektrisk ledning.
Derfor, mens svovl kan bruges i nogle anvendelser, hvor isolering er påkrævet (f.eks. Nogle typer gummi), betragtes det ikke som en god isolator sammenlignet med materialer som glas eller keramik.
 Varme artikler
Varme artikler
-
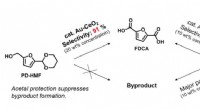 Ny metode muliggør storskalaproduktion af biobaserede plastikflaskerKonventionelle metoder producerer biprodukter, hvilket gør storstilet FDCA-produktion vanskelig, mens denne nye metode giver FDCA effektivt uden dannelse af biprodukter. Kredit:Kim M., et al., Angewan
Ny metode muliggør storskalaproduktion af biobaserede plastikflaskerKonventionelle metoder producerer biprodukter, hvilket gør storstilet FDCA-produktion vanskelig, mens denne nye metode giver FDCA effektivt uden dannelse af biprodukter. Kredit:Kim M., et al., Angewan -
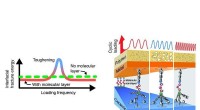 Nanoglue kan gøre kompositter flere gange hårdere under dynamisk belastningIllustrationer af frekvensafhængig hærdning i en polymer-metal-nanogl-keramisk komposit. Kredit:Rensselaer Polytekniske Institut I en opdagelse, der kunne bane vejen for nye materialer og anvendel
Nanoglue kan gøre kompositter flere gange hårdere under dynamisk belastningIllustrationer af frekvensafhængig hærdning i en polymer-metal-nanogl-keramisk komposit. Kredit:Rensselaer Polytekniske Institut I en opdagelse, der kunne bane vejen for nye materialer og anvendel -
 Screen kunne tilbyde bedre sikkerhedstests for nye kemikalierMIT -kemikere har udtænkt en måde at observere overgangstilstanden for den kemiske reaktion, der opstår, når vinylcyanid brydes fra hinanden af en ultraviolet laser. Kredit:Christine Daniloff, MIT
Screen kunne tilbyde bedre sikkerhedstests for nye kemikalierMIT -kemikere har udtænkt en måde at observere overgangstilstanden for den kemiske reaktion, der opstår, når vinylcyanid brydes fra hinanden af en ultraviolet laser. Kredit:Christine Daniloff, MIT -
 Hvordan magnetfelter og 3-D-printere vil skabe morgendagens piller3D-printet reservoir, der bruges til at placere den magnetisk aktiverede svamp og det lægemiddel, der skal afgives ved påføring af et magnetfelt. Kredit:University of Sussex Læger kan snart admini
Hvordan magnetfelter og 3-D-printere vil skabe morgendagens piller3D-printet reservoir, der bruges til at placere den magnetisk aktiverede svamp og det lægemiddel, der skal afgives ved påføring af et magnetfelt. Kredit:University of Sussex Læger kan snart admini
- Hvordan pandemien afslørede revner i globale forsyningskæder
- Hvad er Earth Mantal?
- Forskning viser, at landskaber i det centrale Texas kan blive tørstige, men stadig trives
- Hvorfor betragtes vandet som stof?
- Kemiker får en nanokatalysatorbase fra risskaller
- En ny metode måler integrationen eller adskillelsen af immigranter baseret på deres tweets


