Hvorfor stiger smeltepunktet fra natrium til aluminium?
1. Metallisk binding:
* natrium: Natrium har en relativt svag metallisk binding. Dens enkelt valenselektron holdes løst og deltager i et delokaliseret elektronhav. Denne svage binding kræver mindre energi til at bryde, hvilket resulterer i et lavt smeltepunkt.
* aluminium: Aluminium har tre valenselektroner, der bidrager stærkere til det delokaliserede elektronhav. Dette skaber stærkere metallisk binding, hvilket gør det vanskeligere at bryde og kræve mere energi til at smelte.
2. Atomstørrelse og nuklear ladning:
* natrium: Natrium har en større atomradius end aluminium, med dens valenselektroner længere væk fra kernen. Dette svækker den elektrostatiske tiltrækning mellem kernen og valenselektronerne, hvilket bidrager til svagere metallisk binding.
* aluminium: Aluminium har en mindre atomradius og en højere atomafgift. Denne stærkere tiltrækning mellem kernen og valenselektroner resulterer i en stærkere metallisk binding.
3. Krystalstruktur:
* natrium: Natriumkrystalliserer i en kropscentreret kubisk struktur (BCC). Denne struktur er relativt åben med mindre effektiv pakning af atomer, hvilket fører til svagere interatomiske kræfter og et lavere smeltepunkt.
* aluminium: Aluminium krystalliserer i en ansigt-centreret kubisk (FCC) struktur. Denne struktur er tættere pakket med stærkere interatomiske kræfter, hvilket bidrager til et højere smeltepunkt.
4. Elektronkonfiguration:
* natrium: Natrium har en enkelt valenselektron i 3'erne orbital.
* aluminium: Aluminium har tre valenselektroner i 3'erne og 3p orbitaler. Dette øgede antal valenselektroner bidrager til stærkere metallisk binding.
Kortfattet: Kombinationen af stærkere metallisk binding, mindre atomstørrelse, højere atomladning og mere effektiv krystalpakning i aluminium fører til et signifikant højere smeltepunkt sammenlignet med natrium.
Sidste artikelHvad er den kemiske formel for calciumammoniumnitrat?
Næste artikelEr svovl hexachlorid og dioxid den samme ting?
 Varme artikler
Varme artikler
-
 Sådan får du salt ud af vandet:Få det til at skubbe ud af sig selvDa forskerne begyndte at studere den måde, salte krystalliserer på visse overflader, de fandt ud af, at processen gentagne gange producerede forudsigelige flerbenede former. Forskerne kaldte dem kolle
Sådan får du salt ud af vandet:Få det til at skubbe ud af sig selvDa forskerne begyndte at studere den måde, salte krystalliserer på visse overflader, de fandt ud af, at processen gentagne gange producerede forudsigelige flerbenede former. Forskerne kaldte dem kolle -
 Metaller påvirker C-peptidhormon relateret til insulinUC Davis kemiker Marie Heffern er banebrydende på et nyt felt, metalloendokrinologi, at udforske, hvordan metaller som jern, zink og kobber påvirker hormoner. Kredit:Gregory Urquiaga/UC Davis Meta
Metaller påvirker C-peptidhormon relateret til insulinUC Davis kemiker Marie Heffern er banebrydende på et nyt felt, metalloendokrinologi, at udforske, hvordan metaller som jern, zink og kobber påvirker hormoner. Kredit:Gregory Urquiaga/UC Davis Meta -
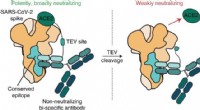 Molekylær makeover gør wimpy antistof til en SARS-CoV-2 tacklerGrafisk abstrakt. Kredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01140-1 Ligesom Roadrunner, der overliste Wile E. Coyote, bliver SARS-CoV-2 (den infektiøse virus, der er ansvarlig f
Molekylær makeover gør wimpy antistof til en SARS-CoV-2 tacklerGrafisk abstrakt. Kredit:Nature Chemical Biology (2022). DOI:10.1038/s41589-022-01140-1 Ligesom Roadrunner, der overliste Wile E. Coyote, bliver SARS-CoV-2 (den infektiøse virus, der er ansvarlig f -
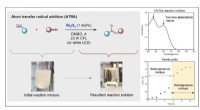 Lysere fremtiden for halvlederbaserede fotokatalytiske processerAtom transfer radikal addition (ATRA) reaktion mellem diethylbrommalonat (DEBM) og 5-hexen-1-ol som en reaktionsmodel. Kredit:Dr. Paola Riente Et samarbejde mellem Pericàs-gruppen med Prof. Timoth
Lysere fremtiden for halvlederbaserede fotokatalytiske processerAtom transfer radikal addition (ATRA) reaktion mellem diethylbrommalonat (DEBM) og 5-hexen-1-ol som en reaktionsmodel. Kredit:Dr. Paola Riente Et samarbejde mellem Pericàs-gruppen med Prof. Timoth


