Ikke -polære molekyler udvikler sig hvornår?
1. Molekylet har en symmetrisk form. Dette betyder, at fordelingen af elektroner er ens i hele molekylet, hvilket resulterer i intet samlet dipolmoment.
2. Molekylet er sammensat af atomer med lignende elektronegativitet. Elektronegativitet er et atomens tendens til at tiltrække elektroner. Når atomer har lignende elektronegativitet, deler de elektroner lige i en kovalent binding. Dette skaber en afbalanceret fordeling af elektroner og derfor intet dipolmoment.
Eksempler:
* CO2 (kuldioxid): Den lineære form af CO2 og den lignende elektronegativitet af carbon- og iltatomer resulterer i et ikke -polært molekyle.
* CH4 (metan): Den tetrahedrale form af methan og den lignende elektronegativitet af kulstof- og hydrogenatomer resulterer i et ikke -polært molekyle.
* O2 (iltgas): Det diatomiske iltmolekyle har en symmetrisk form, og de to iltatomer har lige elektronegativitet. Dette gør det ikke -polært.
I modsætning hertil er polære molekyler:
* Har en asymmetrisk form.
* Har en forskel i elektronegativitet mellem atomerne involveret i molekylet.
Bemærk: Nogle molekyler kan være polære, selvom de har en symmetrisk form, hvis de involverede atomer har en signifikant forskel i elektronegativitet. Dette skaber et dipolmoment inden for molekylet, selvom den overordnede form er symmetrisk.
Sidste artikelHvad er den procentvise sammensætning af Na2SO4?
Næste artikelHvad ændrer svovl sig til 115 grader?
 Varme artikler
Varme artikler
-
 Membranteknologi kan reducere emissioner og energiforbrug i olieraffineringNy membranteknologi kan reducere kulstofemissioner og energiintensitet i forbindelse med raffinering af råolie. Georgia Tech lektor Ryan Lively viser et modul, der indeholder det nye membranmateriale,
Membranteknologi kan reducere emissioner og energiforbrug i olieraffineringNy membranteknologi kan reducere kulstofemissioner og energiintensitet i forbindelse med raffinering af råolie. Georgia Tech lektor Ryan Lively viser et modul, der indeholder det nye membranmateriale, -
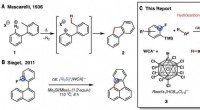 Funktionalisering af uaktiverede alkaner ved hjælp af reaktioner baseret på katalysatorer fremstil…Reaktioner, der involverer formodede phenylkationer. (A) Mascarellis reaktion (12). (B) Siegels intramolekylære Friedel-Crafts reaktion af arylfluorider (15). (C) Vores dobbelte C–F/C–H-funktionaliser
Funktionalisering af uaktiverede alkaner ved hjælp af reaktioner baseret på katalysatorer fremstil…Reaktioner, der involverer formodede phenylkationer. (A) Mascarellis reaktion (12). (B) Siegels intramolekylære Friedel-Crafts reaktion af arylfluorider (15). (C) Vores dobbelte C–F/C–H-funktionaliser -
 Elektrokemisk syntese nu mulig uden elektrisk strømkildeKredit:Tokyo Tech Syntese af organiske forbindelser og polymerer er kernen i mange fremstillingsindustrier. De nye elektrificerende syntese-metoder, der kan kombinere konventionel syntetisk kemi me
Elektrokemisk syntese nu mulig uden elektrisk strømkildeKredit:Tokyo Tech Syntese af organiske forbindelser og polymerer er kernen i mange fremstillingsindustrier. De nye elektrificerende syntese-metoder, der kan kombinere konventionel syntetisk kemi me -
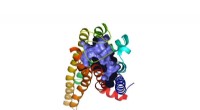 Nye fund om effekten af Epsom salt - Epsom salt receptor identificeretModelpræsentation af den humane bitre receptor TAS2R7, også kendt som Epsom salt receptor. Kredit:Dr. Antonella Di Pizio / Leibniz-LSB@TUM Tyskland Et team af videnskabsmænd ledet af Maik Behrens
Nye fund om effekten af Epsom salt - Epsom salt receptor identificeretModelpræsentation af den humane bitre receptor TAS2R7, også kendt som Epsom salt receptor. Kredit:Dr. Antonella Di Pizio / Leibniz-LSB@TUM Tyskland Et team af videnskabsmænd ledet af Maik Behrens


