Hvorfor får svovl elektroner, når de danner ioniske bindinger?
* Elektronkonfiguration: Svovl har 6 valenselektroner (elektroner i sin yderste skal). For at blive stabil har det brug for 8 valenselektroner (som den ædle gas -argon).
* octet regel: Octet -reglen siger, at atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en fuld ydre skal af 8 elektroner.
* Elektronegativitet: Svovl er mere elektronegativ end mange metaller. Dette betyder, at det har en stærkere attraktion for elektroner.
* ionisk bindingsdannelse: Når svovl møder et metal (som natrium, NA), som har en lavere elektronegativitet og kun 1 valenselektron, stjæler svovl "det elektron. Dette efterlader svovl med 7 elektroner i dens ydre skal, og metallet (som natrium) bliver positivt ladet.
Resultatet er, at svovl bliver en negativt ladet ion (S²⁻), og metallet bliver en positivt ladet ion (Na⁺). Disse modsatte ladede ioner tiltrækker hinanden og danner en ionisk binding.
Kort sagt får svovl elektroner i ioniske bindinger for at opnå en stabil oktetkonfiguration og en negativ ladning.
Sidste artikelHvad er natrium plus ilt lig med?
Næste artikelHvad er massetalet svovl?
 Varme artikler
Varme artikler
-
 Nyt materiale viser sig at afsalte vand mere effektivtKredit:University of Notre Dame Inden 2025, to tredjedele af verdens befolkning kan opleve mangel på ferskvand. For at løse dette problem, forskere fra University of Notre Dame har identificeret e
Nyt materiale viser sig at afsalte vand mere effektivtKredit:University of Notre Dame Inden 2025, to tredjedele af verdens befolkning kan opleve mangel på ferskvand. For at løse dette problem, forskere fra University of Notre Dame har identificeret e -
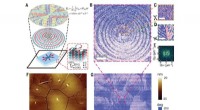 Koncentriske cirkulære polariseringsbånd fundet i en ferroelektrisk polymerObservation af toroidal polær topologi. Kredit: Videnskab (2021). DOI:10.1126/science.abc4727 Et team af forskere fra Kina, USA og Australien har fundet et eksempel på dannelsen af koncentriske
Koncentriske cirkulære polariseringsbånd fundet i en ferroelektrisk polymerObservation af toroidal polær topologi. Kredit: Videnskab (2021). DOI:10.1126/science.abc4727 Et team af forskere fra Kina, USA og Australien har fundet et eksempel på dannelsen af koncentriske -
 Fedtsyreråvarer muliggør en højeffektiv glyoxylat-TCA-cyklus til højudbytteproduktion af β-alan…(A) Sammenligning af metaboliske veje for bioproduktion af C4 tricarboxylsyre (TCA) cyklus mellemprodukter (OAA) fra FA eller glucose råvarer. (B) Design af glyoxylat-TCA-cyklus til effektiv produktio
Fedtsyreråvarer muliggør en højeffektiv glyoxylat-TCA-cyklus til højudbytteproduktion af β-alan…(A) Sammenligning af metaboliske veje for bioproduktion af C4 tricarboxylsyre (TCA) cyklus mellemprodukter (OAA) fra FA eller glucose råvarer. (B) Design af glyoxylat-TCA-cyklus til effektiv produktio -
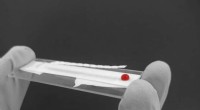 Radikal diagnostik kan redde millioner af mennesker, der risikerer at dø af blodtabFibrinogendiagnostik udviklet af forskere ved Monash University. Kredit:Monash University / BioPRIA Ingeniører ved Monash University i Australien har udviklet en hurtig, bærbar og billig diagnosti
Radikal diagnostik kan redde millioner af mennesker, der risikerer at dø af blodtabFibrinogendiagnostik udviklet af forskere ved Monash University. Kredit:Monash University / BioPRIA Ingeniører ved Monash University i Australien har udviklet en hurtig, bærbar og billig diagnosti
- Implementering af et praktisk kvantesikkert direkte kommunikationssystem
- Er det muligt for klipper i rockcyklussen at springe over at blive sedimentær rock?
- Hvilket sammensat navn er RBCLO2?
- Undslipper varme ud i rummet, eller genbruges den på denne planet?
- Er det sandt, når elektroner overføres mellem to atomer, dannes der en kovalent binding.?
- Sådan vokser og hæver Dragonflies i et hus Box


