Ville en svovl blive positiv ion inden binding?
Her er hvorfor:
* Elektronegativitet: Svovl har en relativt høj elektronegativitet (2,58 på Pauling -skalaen). Dette betyder, at det har en stærk tendens til at tiltrække elektroner mod sig selv.
* ioniseringsenergi: Svovl har en relativt høj ioniseringsenergi, hvilket betyder, at den kræver en betydelig mængde energi for at fjerne en elektron og danne en positiv ion (kation).
Derfor er det mere sandsynligt, at svovl er gain Elektroner for at opnå en stabil oktet og blive en negativ ion (anion) ved binding.
Der er dog nogle undtagelser:
* med stærkt elektronegative elementer: Svovl kan danne positive ioner, når de er bundet til elementer med meget højere elektronegativitet, såsom ilt (i forbindelser som So₂ eller SO₃).
* i specifikke reaktioner: Under visse betingelser kan svovl miste elektroner for at danne en positiv ion, men disse er mindre almindelige end dens tendens til at få elektroner.
Generelt er det mere sandsynligt, at svovl fungerer som en anion I de fleste bindingsscenarier på grund af dets elektronegativitet og ioniseringsenergi.
 Varme artikler
Varme artikler
-
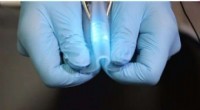 Sådan ser et stretchy kredsløb udForskere i Kina har lavet et nyt hybrid ledende materiale - del elastisk polymer, del flydende metal - der kan bøjes og strækkes efter ønske. Kredsløb lavet med dette materiale kan have de fleste todi
Sådan ser et stretchy kredsløb udForskere i Kina har lavet et nyt hybrid ledende materiale - del elastisk polymer, del flydende metal - der kan bøjes og strækkes efter ønske. Kredsløb lavet med dette materiale kan have de fleste todi -
 Væsen funktion:Vridende revner giver superhelte sejhed til dyrMantis-rejen erobrer sit bytte med et dactyl club vedhæng, som er opbygget af et kompositmateriale, der bliver sejere, efterhånden som revner vrider sig. Kredit:Purdue University billede/Pablo Zavatti
Væsen funktion:Vridende revner giver superhelte sejhed til dyrMantis-rejen erobrer sit bytte med et dactyl club vedhæng, som er opbygget af et kompositmateriale, der bliver sejere, efterhånden som revner vrider sig. Kredit:Purdue University billede/Pablo Zavatti -
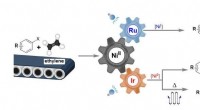 Katalytisk omdannelse af ethylenIllustration, der viser de nikkelkatalyserede reaktioner mellem kommercielt tilgængeligt arylhalogenid og ethylen. Oxidationstilstanden af nikkelkatalysatoren ændres til +1 eller 0, når den modulere
Katalytisk omdannelse af ethylenIllustration, der viser de nikkelkatalyserede reaktioner mellem kommercielt tilgængeligt arylhalogenid og ethylen. Oxidationstilstanden af nikkelkatalysatoren ændres til +1 eller 0, når den modulere -
 Inspireret af snegle, forskere opfinder et reversibelt klæbemiddel, der er stærkt nok til at holde…Kredit:CC0 Public Domain Superlim er utrolig nyttigt - lige indtil du ender med at blive knyttet til dit håndværksprojekt. Men et nyt klæbemiddel opfundet af forskere fra University of Pennsylvani
Inspireret af snegle, forskere opfinder et reversibelt klæbemiddel, der er stærkt nok til at holde…Kredit:CC0 Public Domain Superlim er utrolig nyttigt - lige indtil du ender med at blive knyttet til dit håndværksprojekt. Men et nyt klæbemiddel opfundet af forskere fra University of Pennsylvani
- Hvilken procentdel af den amerikanske elektricitet produceres af kulenergi?
- Hvordan er elektromagneter nyttige, når data overføres til et kreditkort?
- Hvad er en seismisk bølge, der rejser gennem jordens interiør?
- Forskere dokumenterer den første brug af majs i Mesoamerika
- Kvindens gigantiske spring:hvem bliver den første kvindelige moonwalker?
- Hvad kaldes linjen gennem midten af solen?


