Sammenlign og kontrast egenskaberne ved individuelle elementer, der kombineres for at fremstille salt med sammensat salt?
Individuelle elementer
* natrium (NA)
* udseende: Silvery-hvid, blødt metal
* reaktivitet: Meget reaktiv, reagerer voldsomt med vand
* tilstand ved stuetemperatur: Solid
* Konduktivitet: God leder af elektricitet
* klor (Cl)
* udseende: Gulgrøn gas
* reaktivitet: Meget reaktiv, et stærkt oxidationsmiddel
* tilstand ved stuetemperatur: Gas
* Konduktivitet: Dårlig leder af elektricitet
Sammensæt salt (natriumchlorid, NaCl)
* udseende: Hvidt krystallinsk fast stof
* reaktivitet: Relativt ureaktiv, stabil forbindelse
* tilstand ved stuetemperatur: Solid
* Konduktivitet: God leder af elektricitet, når den blev opløst i vand (på grund af dannelsen af ioner)
Sammenligning og kontrast
Ligheder:
* elementer: Både natrium og klor er elementer, hvilket betyder, at de kun består af en type atom.
* solid tilstand: Både de individuelle elementer og forbindelsen findes som faste stoffer ved stuetemperatur.
* Konduktivitet: Både natrium- og natriumchlorid kan udføre elektricitet, dog på forskellige måder (natriumdirektør som et metal, mens natriumchlorid udføres, når det opløstes i vand).
Forskelle:
* udseende og reaktivitet: De individuelle elementer har drastisk forskellige optrædener og reaktivitet sammenlignet med det sammensatte salt. Natrium er et meget reaktivt metal, og klor er en giftig gas, mens natriumchlorid er et stabilt, hvidt krystallinsk fast stof.
* Kemisk sammensætning: Natriumchlorid dannes af den kemiske reaktion af natrium og klor, hvilket resulterer i en helt anden kemisk sammensætning og egenskaber.
* toksicitet: Natrium og klor er meget giftigt, mens natriumchlorid er essentielt for menneskeliv i moderation.
nøglepunkter at huske
* Kemisk binding: Dannelsen af salt (NaCl) involverer en stærk ionisk binding mellem natrium- og kloratomer. Denne binding ændrer fuldstændigt egenskaberne for de individuelle elementer.
* Nye egenskaber: Dannelsen af en forbindelse som salt resulterer i fremkomsten af helt nye egenskaber, der ikke er til stede i de originale elementer.
Fortæl mig, hvis du gerne vil have flere oplysninger om specifikke egenskaber!
Sidste artikelHvilken er den bedste forsigtighed mod kulilte -poiso ning?
Næste artikelEt reaktivt metal, hvis forbindelser udgør kalksten?
 Varme artikler
Varme artikler
-
 Påvisning af aromaer i lagret cognacKredit:CC0 Public Domain For kendere af vin og spiritus, en del af nydelsen er at bemærke de forskellige smage og dufte, der afsløres med hver slurk. Aldring forvandler alkoholens aroma yderligere
Påvisning af aromaer i lagret cognacKredit:CC0 Public Domain For kendere af vin og spiritus, en del af nydelsen er at bemærke de forskellige smage og dufte, der afsløres med hver slurk. Aldring forvandler alkoholens aroma yderligere -
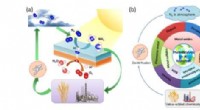 Fotokemisk nitrogenfiksering – åbner nye udsigter mod en bæredygtig energifremtid(a) En oversigt over N2-kredsløbet og cirkulationen af N2 i forskellige former. (b) Illustration af den avancerede forskning i udviklingen af fotokatalysatorer til N2-fiksering. Kredit:A*STAR og W
Fotokemisk nitrogenfiksering – åbner nye udsigter mod en bæredygtig energifremtid(a) En oversigt over N2-kredsløbet og cirkulationen af N2 i forskellige former. (b) Illustration af den avancerede forskning i udviklingen af fotokatalysatorer til N2-fiksering. Kredit:A*STAR og W -
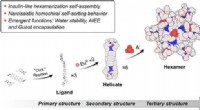 Hexameriske lanthanid-organiske kapsler med tertiær struktur, nye funktionerKredit: Journal of the American Chemical Society (2021). DOI:10.1021/jacs.1c01168 Metalrettede samlinger er blevet en meget brugt tilgang til at designe sofistikerede og multifunktionelle kunstig
Hexameriske lanthanid-organiske kapsler med tertiær struktur, nye funktionerKredit: Journal of the American Chemical Society (2021). DOI:10.1021/jacs.1c01168 Metalrettede samlinger er blevet en meget brugt tilgang til at designe sofistikerede og multifunktionelle kunstig -
 Forudsigelse af forvrængning og ydeevne af dele fremstillet ved additiv fremstillingKredit:CC0 Public Domain Undersøgelser af de resterende spændinger, der dannes under en additiv fremstillingsproces (AM) har afsløret, at bygningsorienteringen af den del, der produceres, har en
Forudsigelse af forvrængning og ydeevne af dele fremstillet ved additiv fremstillingKredit:CC0 Public Domain Undersøgelser af de resterende spændinger, der dannes under en additiv fremstillingsproces (AM) har afsløret, at bygningsorienteringen af den del, der produceres, har en
- Troede du, at olieudslippet var slemt? I LA, giftigt affald er overalt
- Lasere bruges til at lave første bor-nitrid nanorørgarn (m/ video)
- Hvad sker der med energi, når stof gennemgår en kemisk forandring eller fysisk forandring?
- Liste over husholdningsbaser og syre
- Hvor mange mol ammoniak kan der fremstilles af 18 brint?
- Nanoteknologi leverer hepatitis B-vaccine


