Hvad er Lewis Dot eller Electron Diagram over hydrogenmel?
1. Bestem antallet af valenselektroner:
* Hydrogen (H) har 1 valenselektron.
* Fluor (F) har 7 valenselektroner.
2. Arranger atomerne:
* Hydrogen er mindre elektronegativ end fluor, så det vil være det centrale atom.
* Da brint kun kan danne en binding, vil fluor i det væsentlige være det centrale atom i dette tilfælde.
3. Tilslut atomerne med en enkelt binding:
* Tegn en enkelt linje mellem brint og fluoratomer, der repræsenterer et delt par elektroner.
4. Distribuer resterende valenselektroner som ensomme par:
* Fluor har brug for 8 elektroner for at afslutte sin oktet. Den har allerede 2 elektroner fra bindingen, så tilsæt 6 mere som tre ensomme par rundt om fluoratomet.
5. Den sidste Lewis -struktur:
`` `
H - f
:
:
:
`` `
Vigtig note: De ensomme par er ofte repræsenteret af prikker, men i dette tilfælde bruges kolonerne til at indikere tilstedeværelsen af elektronparene.
Sidste artikelKan kobberchloridopløsning udføre elektricitet?
Næste artikelHvad er det vigtigste kvanteantal svovl?
 Varme artikler
Varme artikler
-
 Solbrint:Lad os overveje stabiliteten af fotoelektroderSkalerbart stort område BiVO 4 fotoanode på FTO med Ni strømaftagere. Kredit:HZB Brint er et alsidigt brændstof, der kan lagre og frigive kemisk energi, når det er nødvendigt. Brint kan producer
Solbrint:Lad os overveje stabiliteten af fotoelektroderSkalerbart stort område BiVO 4 fotoanode på FTO med Ni strømaftagere. Kredit:HZB Brint er et alsidigt brændstof, der kan lagre og frigive kemisk energi, når det er nødvendigt. Brint kan producer -
 Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa
Opdagelse af en ny lov om faseadskillelseForskere ved University of Tokyo opdager en ny lov om, hvordan det komplekse netværk af faseadskilte strukturer vokser med tiden, hvilket kan føre til mere effektive batterier og industrielle katalysa -
 Fejl fundet i vandbehandlingsmetoden - Processen kan uforvarende generere skadelige kemikalierKredit:CC0 Public Domain Offentlig vandkvalitet har fået stor opmærksomhed i de senere år, da der er gjort nogle foruroligende opdagelser vedrørende blyniveauer i byer over hele landet. Nu, en ny
Fejl fundet i vandbehandlingsmetoden - Processen kan uforvarende generere skadelige kemikalierKredit:CC0 Public Domain Offentlig vandkvalitet har fået stor opmærksomhed i de senere år, da der er gjort nogle foruroligende opdagelser vedrørende blyniveauer i byer over hele landet. Nu, en ny -
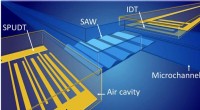 NIST-opdagelse kan øge nøjagtigheden ved måling af blodgennemstrømning til kræftdiagnose, andre…Akustiske overfladebølger (SAW) bevæger sig gennem en mikrovæske begrænset til et hulrum eller en mikrokanal og analyseres derefter af modtageren. Både den akustiske bølgesender (SPUDT) og modtageren
NIST-opdagelse kan øge nøjagtigheden ved måling af blodgennemstrømning til kræftdiagnose, andre…Akustiske overfladebølger (SAW) bevæger sig gennem en mikrovæske begrænset til et hulrum eller en mikrokanal og analyseres derefter af modtageren. Både den akustiske bølgesender (SPUDT) og modtageren
- Hvordan påvirker tilgængeligheden af råvarer til fotosyntesen?
- Faktorer i fremstillingen af heterojunctions af 2-D materialer gennem CVD
- Bjerge lavet af enorme klipper adskilt fra andre af fejl er bjerge?
- Hvilket objekt kan bruges til kernen?
- Studiet afslører karakteren af unge stjerner nær kometkuglen CG 30
- Unikke organiske lys-emitterende molekylære emittere


