Kan kobberchloridopløsning udføre elektricitet?
* elektrolytter: Kobberchlorid (Cucl₂) er en ionisk forbindelse. Når det er opløst i vand, adskiller den sig i dets bestanddele:Cu²⁺ (kobberioner) og Cl⁻ (chloridioner).
* opladningsbærere: Disse ioner er frie til at bevæge sig gennem opløsningen. Når der påføres en spænding, bevæger de positive kobberioner mod den negative elektrode (katode), og de negative chloridioner bevæger sig mod den positive elektrode (anode). Denne bevægelse af ladede partikler udgør en elektrisk strøm.
I det væsentlige muliggør tilstedeværelsen af frie ioner i løsningen ledning af elektricitet.
Bemærk: Ledningsevnen af opløsningen afhænger af faktorer som koncentrationen af kobberchloridet og temperaturen.
Sidste artikelEr kalium mere reaktiv eller mindre end brint?
Næste artikelHvad er Lewis Dot eller Electron Diagram over hydrogenmel?
 Varme artikler
Varme artikler
-
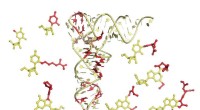 Ny måde at se RNA på kan hjælpe med at bekæmpe patogenerTransfer RNA molekyler (midten) er essentielle for at oversætte den genetiske information i DNA til proteiner. Ny forskning giver et detaljeret billede af kemiske modifikationer (vist med rødt) til tR
Ny måde at se RNA på kan hjælpe med at bekæmpe patogenerTransfer RNA molekyler (midten) er essentielle for at oversætte den genetiske information i DNA til proteiner. Ny forskning giver et detaljeret billede af kemiske modifikationer (vist med rødt) til tR -
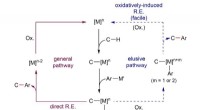 Forskere opnår arylering af CH-bindinger under milde forholdOxidation af metallet (M, iridium, blå vej) fører til et fald på 19 kcal/mol i reaktionens energibarriere, og tillader aryleringen at ske ved stuetemperatur. Kredit:Institut for Grundvidenskab Car
Forskere opnår arylering af CH-bindinger under milde forholdOxidation af metallet (M, iridium, blå vej) fører til et fald på 19 kcal/mol i reaktionens energibarriere, og tillader aryleringen at ske ved stuetemperatur. Kredit:Institut for Grundvidenskab Car -
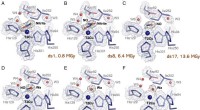 Molekylære film kaster lys over enzym involveret i drivhusgasproduktionT2Cu-sted under MSOX-serien af en nitrit-gennemvædet Br2D NiR krystal. (A) T2Cu-stedet efter første eksponering for 0,8-MGy røntgenstråler (DS1), der viser fuld belægning af en enkelt side-on nitrit
Molekylære film kaster lys over enzym involveret i drivhusgasproduktionT2Cu-sted under MSOX-serien af en nitrit-gennemvædet Br2D NiR krystal. (A) T2Cu-stedet efter første eksponering for 0,8-MGy røntgenstråler (DS1), der viser fuld belægning af en enkelt side-on nitrit -
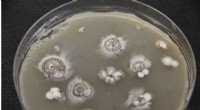 Forskere finder potentielle sygdomsbekæmpende sprænghoveder gemt i bakterierDyrkning af en thiocarboxylsyre producerende stamme af bakterier. Kredit:Shen Lab / The Scripps Research Institute Bakterier fundet i jord kan indeholde en potentiel game-changer for lægemiddeldes
Forskere finder potentielle sygdomsbekæmpende sprænghoveder gemt i bakterierDyrkning af en thiocarboxylsyre producerende stamme af bakterier. Kredit:Shen Lab / The Scripps Research Institute Bakterier fundet i jord kan indeholde en potentiel game-changer for lægemiddeldes
- Hvad laver jernklorid og natriumhydroxid?
- Banebrydende visualisering af atomare bevægelser
- Hvordan bidrager en alligator til kulstofkredsløbet?
- Hvad er en organisk biogen sedimentær sten - basalt kul sandsten eller konglomerat?
- En ny forståelse af galakseudviklingen med NASAs romerske rumteleskop
- Opdagelse af falsk finne afslører nye ichthyosaur-arter


