Er kalium mere reaktiv eller mindre end brint?
* Elektrokemisk serie: Kalium sidder højere i den elektrokemiske serie end brint. Dette betyder, at kalium har en større tendens til at miste elektroner og danne positive ioner (kationer).
* reaktivitetstendenser: Reaktivitet øges generelt, når du bevæger dig ned ad en gruppe i den periodiske tabel. Kalium er under brint i gruppe 1 (alkalimetaller).
* reaktion med vand: Kalium reagerer kraftigt med vand, frigiver brintgas og genererer varme. Denne reaktion er meget mere voldelig end reaktionen af brint med vand.
Eksempel:
* kalium: 2K (S) + 2H₂O (L) → 2KOH (AQ) + H₂ (G)
* brint: H₂ (G) + ½O₂ (G) → H₂O (L)
Sammenfattende peger kaliums position i den periodiske tabel, dens større tendens til at miste elektroner og dens energiske reaktion med vand alle på dets højere reaktivitet sammenlignet med brint.
 Varme artikler
Varme artikler
-
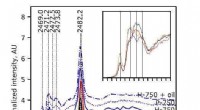 Hvordan lavede de gamle mestre deres ultramarine?XANES resultater for malingprøver fra de fem undersøgte malerier. Mønsteret i venstre side af spektret er en indikation af opvarmningen af lapis lazuli under forberedelsen af ultramarinen. Kredit:
Hvordan lavede de gamle mestre deres ultramarine?XANES resultater for malingprøver fra de fem undersøgte malerier. Mønsteret i venstre side af spektret er en indikation af opvarmningen af lapis lazuli under forberedelsen af ultramarinen. Kredit: -
 En afhandling bragte nye højpræcisionsmassemålinger for atommasser af isotoper tungere end jernKredit:CC0 Public Domain En stor del af de grundstoffer, der omgiver os, produceres i fusionsreaktioner i stjerner. Imidlertid, grundstoffer tungere end jern kræver mere komplekse processer, der f
En afhandling bragte nye højpræcisionsmassemålinger for atommasser af isotoper tungere end jernKredit:CC0 Public Domain En stor del af de grundstoffer, der omgiver os, produceres i fusionsreaktioner i stjerner. Imidlertid, grundstoffer tungere end jern kræver mere komplekse processer, der f -
 Komposterbart biolæder tilbyder bæredygtige løsninger til tøjindustrien og videreMikrobiel biofabrikation og grøn forarbejdning inspireret af kulturarv tilbyder en vej til en cirkulær materialeøkonomi. Kredit:Theanne Schiros/Columbia Engineering og FIT Siden begyndelsen af de
Komposterbart biolæder tilbyder bæredygtige løsninger til tøjindustrien og videreMikrobiel biofabrikation og grøn forarbejdning inspireret af kulturarv tilbyder en vej til en cirkulær materialeøkonomi. Kredit:Theanne Schiros/Columbia Engineering og FIT Siden begyndelsen af de -
 Stabilisering af emulsionsforskning forbedrer brandslukningsoperationer og mereKredit:Unsplash/CC0 Public Domain Forskere ved Texas A&M University har fundet en måde at kontrollere ladningen af nanopartikler på en to-væske grænseflade for at skabe et mere stabilt system, hv
Stabilisering af emulsionsforskning forbedrer brandslukningsoperationer og mereKredit:Unsplash/CC0 Public Domain Forskere ved Texas A&M University har fundet en måde at kontrollere ladningen af nanopartikler på en to-væske grænseflade for at skabe et mere stabilt system, hv
- Loven om bevægelse, der siger, at en objekter acceleration er retning direkte relateret til den anv…
- 5 Eksempel på god ledervarme?
- Hvad er definitionen af bakterier?
- Forbindelse, der er vital for alt liv, har sandsynligvis spillet en rolle i livets oprindelse, tyder…
- Gør plastik mere gennemsigtigt og tilføjer samtidig elektrisk ledningsevne
- Hvordan blev konstellationen Leo opdaget?


