Hvordan ville opløseligheden af SO2 ændre sig, når temperaturen stiger?
* gasopløselighed: Gasser bliver generelt mindre opløselige i væsker, når temperaturen øges. Dette skyldes, at gasmolekylerne ved højere temperaturer har mere kinetisk energi, hvilket gør dem mere tilbøjelige til at flygte fra væskefasen og komme ind i gasfasen.
* SO2 som gas: SO2 er en gas ved stuetemperatur og tryk.
* Processen: Når SO2 opløses i vand, danner den en svag syre (svovlsyre, H2SO3). Denne reaktion er eksoterm, hvilket betyder, at den frigiver varme. I henhold til Le Chateliers princip vil forøgelse af temperaturen på en eksoterm reaktion skifte ligevægt mod reaktanterne (SO2 og vand). Dette betyder, at mere SO2 vil flygte fra opløsningen, hvilket fører til lavere opløselighed.
Kortfattet:
* Højere temperaturer favoriserer Escape of SO2 fra opløsningen, hvilket reducerer dens opløselighed.
* Dette skyldes den øgede kinetiske energi fra SO2 -molekylerne og den eksotermiske karakter af opløsningsprocessen.
Sidste artikelHvilket element har 28 subatomære partikler i kernen i et atom?
Næste artikelHvad er en kemisk formel for svovl plus klor?
 Varme artikler
Varme artikler
-
 Forskere skaber en ny klasse af hastighedsfølsomme mekaniske metamaterialerKredit:Delft University of Technology Forskere ved Institut for Biomekanisk Teknik ved Delft University of Technology har skabt en ny klasse af metamaterialer, der dynamisk kan ændre deres mekanis
Forskere skaber en ny klasse af hastighedsfølsomme mekaniske metamaterialerKredit:Delft University of Technology Forskere ved Institut for Biomekanisk Teknik ved Delft University of Technology har skabt en ny klasse af metamaterialer, der dynamisk kan ændre deres mekanis -
 En kontrollerbar membran til at trække kuldioxid ud af udstødningsstrømmeneKredit:CC0 Public Domain Et nyt system udviklet af kemiske ingeniører ved MIT kunne give en måde til kontinuerligt at fjerne kuldioxid fra en strøm af affaldsgasser, eller endda fra luften. Nøglek
En kontrollerbar membran til at trække kuldioxid ud af udstødningsstrømmeneKredit:CC0 Public Domain Et nyt system udviklet af kemiske ingeniører ved MIT kunne give en måde til kontinuerligt at fjerne kuldioxid fra en strøm af affaldsgasser, eller endda fra luften. Nøglek -
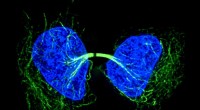 Nyt værktøj gør det muligt for forskere at fange undvigende protein i aktionMed spastazolin, forskere kan studere tidligere utilgængelige komponenter i celledeling. Kredit:Rockefeller University Ligesom mange af de processer, der driver en celles grundlæggende funktioner,
Nyt værktøj gør det muligt for forskere at fange undvigende protein i aktionMed spastazolin, forskere kan studere tidligere utilgængelige komponenter i celledeling. Kredit:Rockefeller University Ligesom mange af de processer, der driver en celles grundlæggende funktioner, -
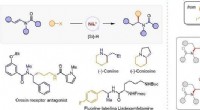 Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National
Kirale aminer syntetiseret ved nikkelkatalyseret asymmetrisk reduktiv hydroalkyleringSyntese af chirale alifatiske aminer ved reduktiv hydroalkylering af enamider. Kredit:WANG Jiawang For nylig, en forskergruppe ledet af prof. Fu Yao og associeret forsker Lu Xi fra Hefei National


