Hvad er mønstre på tværs af periode 3 pH af vandige chloridopløsninger?
forståelse af forholdet
* metalchlorider og hydrolyse: Når metalchlorider (som NaCl, MGCL₂, alcl₃) opløses i vand, kan metalkationerne interagere med vandmolekyler. Denne interaktion kan føre til hydrolyse, hvor metalkationen tiltrækker elektroner fra iltatomet af vand, hvilket svækker O-H-bindingen. De resulterende H⁺ioner bidrager til surhedsgrad.
* ikke -metalchlorider og hydrolyse: Ikke -metalchlorider (som SICL₄, PCL₃, SCL₂) reagerer kraftigt med vand og producerer sure opløsninger. Reaktionen involverer dannelse af oxoacider (som HCLO₄, H₃po₄, H₂so₄), som er stærke syrer.
periode 3 Trends
1. natriumchlorid (NaCl): NaCl er et neutralt salt; Dens opløsning er hverken sur eller grundlæggende. Natriumioner (Na⁺) hydrolyserer ikke signifikant.
2. magnesiumchlorid (MGCL₂): MGCL₂ -opløsninger er let sure. Mg²⁺ionen er en svagere Lewis -syre sammenlignet med al³⁺, men den gennemgår stadig nogle hydrolyse for at frigive H⁺ioner.
3. aluminiumchlorid (alcl₃): ALCL₃ -opløsninger er sure. Al³⁺ionen er en stærk Lewis -syre. Det hydrolyserer let, frigiver en betydelig mængde H⁺ioner, hvilket gør opløsningen sur.
4. siliciumtetrachlorid (sicl₄): SICL₄ reagerer voldsomt med vand og producerer saltsyre (HCI) og silicinsyre (H₄sio₄). Denne reaktion fører til en meget sur opløsning.
5. fosfor trichlorid (PCL₃): PCL₃ reagerer med vand til dannelse af fosforsyre (H₃po₃) og saltsyre (HCI). Den resulterende opløsning er sur.
6. svovldichlorid (SCL₂): SCL₂ reagerer med vand til dannelse af svovlsyre (H₂so₃) og saltsyre (HCI). Løsningen er sur.
nøgleobservationer
* surhedsgrad stiger fra venstre mod højre: Når du bevæger dig over periode 3, øges surhedsgraden af chloridopløsningerne generelt. Dette skyldes, at elementernes metalliske karakter falder, hvilket fører til større Lewis -surhedsgrad i metalkationerne og mere kraftige hydrolysereaktioner med vand.
* Ikke -metalchlorider er meget sure: Ikke -metalchlorider reagerer med vand for at producere stærke syrer, hvilket resulterer i stærkt sure opløsninger.
Vigtig note: Aciditeten af disse opløsninger afhænger af faktorer som koncentration og temperatur. Disse tendenser giver en generel oversigt.
 Varme artikler
Varme artikler
-
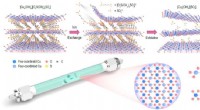 Ultrathin 2D-cuprat med aktive periodiske kobber-enkeltsteder, en ny katalysator for Chan-lam-koblin…Illustrationen af anionbytningsstrategi til top-down eksfoliering af bulk-kupratmaterialer [Cu4 (OH)6 ][O3 S(CH2 )4 SO3 ] i atomisk tynde 2D-CuSSs og Atomic model af 2D-CuSSs. Kredit:Science China P
Ultrathin 2D-cuprat med aktive periodiske kobber-enkeltsteder, en ny katalysator for Chan-lam-koblin…Illustrationen af anionbytningsstrategi til top-down eksfoliering af bulk-kupratmaterialer [Cu4 (OH)6 ][O3 S(CH2 )4 SO3 ] i atomisk tynde 2D-CuSSs og Atomic model af 2D-CuSSs. Kredit:Science China P -
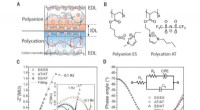 Ionotronisk teknologi, der ikke kræver flydende elektrolytterDannelse af en IDL ved grænsefladen mellem to modsat ladede ionoelastomerer. (A) Skematisk illustration af en polyanion/polykation-forbindelse. Kulstof-nanorørelektroder med stort overfladeareal er in
Ionotronisk teknologi, der ikke kræver flydende elektrolytterDannelse af en IDL ved grænsefladen mellem to modsat ladede ionoelastomerer. (A) Skematisk illustration af en polyanion/polykation-forbindelse. Kulstof-nanorørelektroder med stort overfladeareal er in -
 NIST finder en måde at måle brændselscelleudskrivning ved et hurtigt klipGodt kontrolleret belysning gør det muligt for teamets prototype-enhed (øverst til venstre) at scanne tynde lag væske, der indeholder platin-nanopartikler (nederste center), en katalysator, der bruges
NIST finder en måde at måle brændselscelleudskrivning ved et hurtigt klipGodt kontrolleret belysning gør det muligt for teamets prototype-enhed (øverst til venstre) at scanne tynde lag væske, der indeholder platin-nanopartikler (nederste center), en katalysator, der bruges -
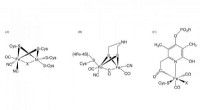 CO-biosyntese påkrævet til samling af det aktive sted i NiFe-hydrogenaseFigur 1. Struktur af de aktive steder i [NiFe] -hydrogenase, [FeFe] -hydrogenase, og [Fe] -hydrogenase Kredit:NINS/IMS En forskergruppe, der omfatter forskere fra Exploratory Research Center on Li
CO-biosyntese påkrævet til samling af det aktive sted i NiFe-hydrogenaseFigur 1. Struktur af de aktive steder i [NiFe] -hydrogenase, [FeFe] -hydrogenase, og [Fe] -hydrogenase Kredit:NINS/IMS En forskergruppe, der omfatter forskere fra Exploratory Research Center on Li
- Hvor mange iltatom er i 5 molekyler OH H2SO4?
- Hvad er meget videnskabelige ord?
- Hvor meget koster effekten af en maskine, der løfter 500 kg objekt gennem højde 20 m i tid 60'er…
- Raketmotorer fungerer efter princippet om?
- Huse i orkanangreb zoner er bygget større tilbage
- Forskere foreslår, at ectomycorrhizal svampes rolle integreres i kulstofregnskabet


